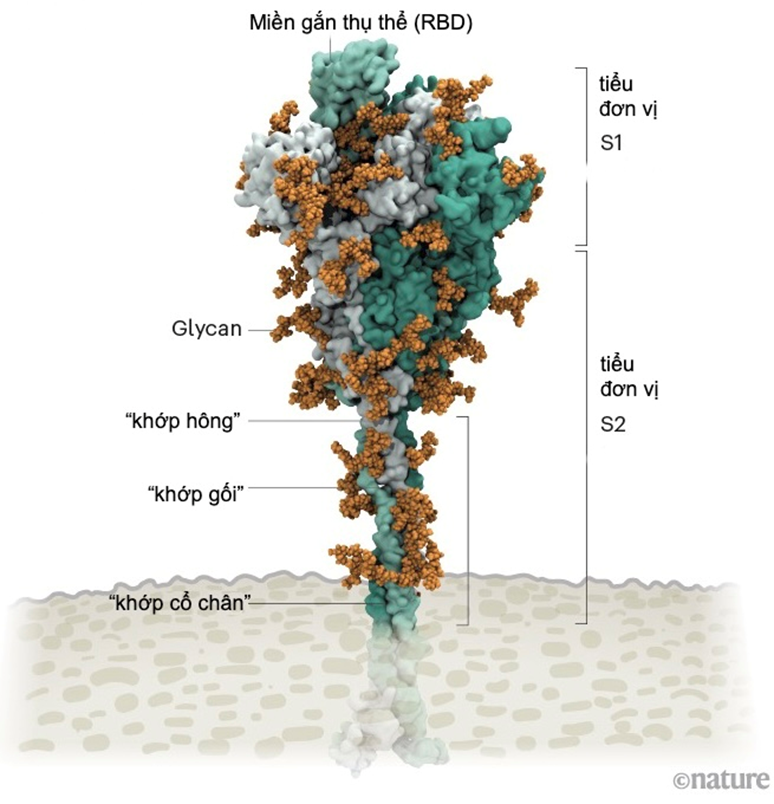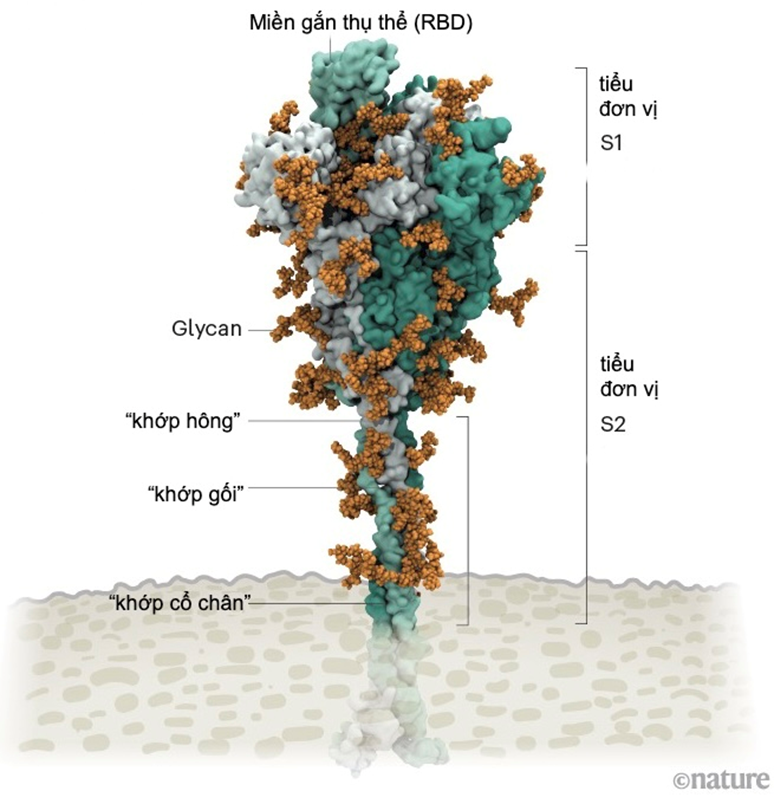
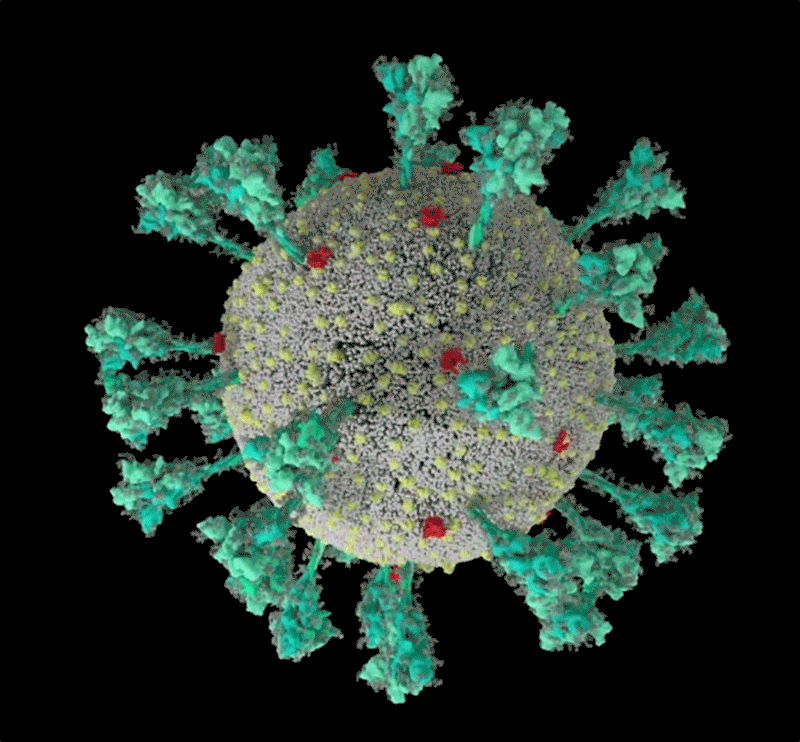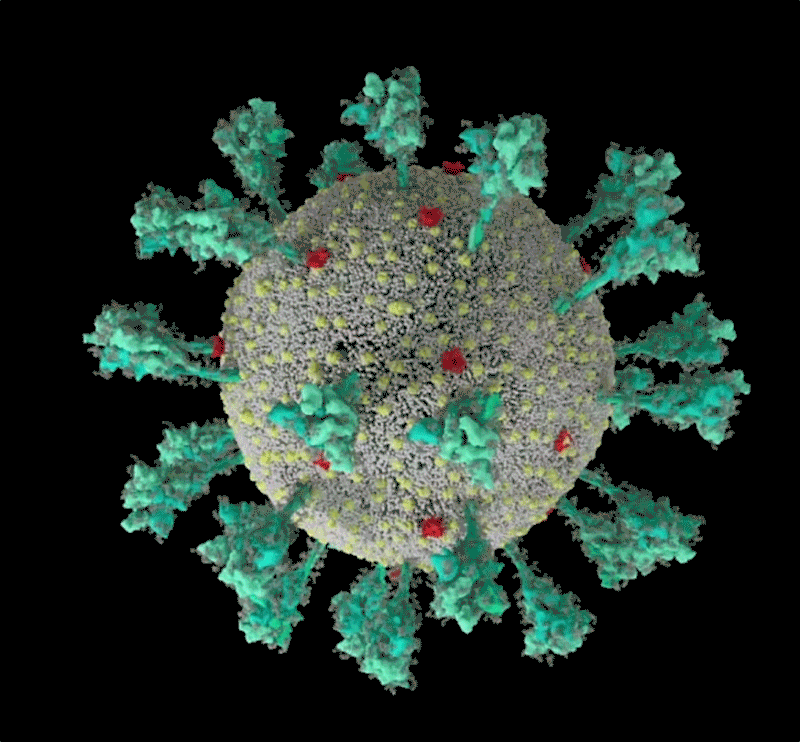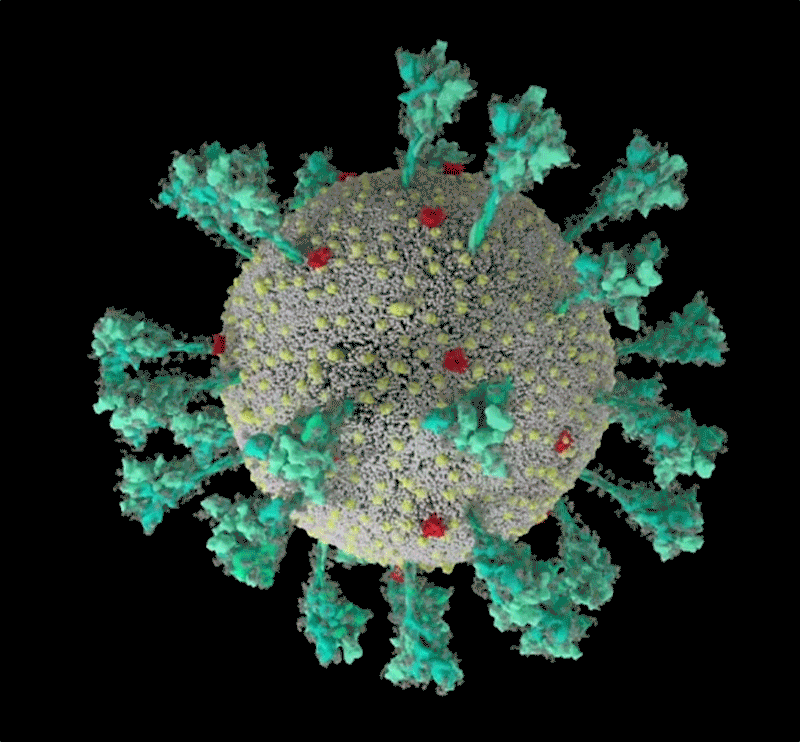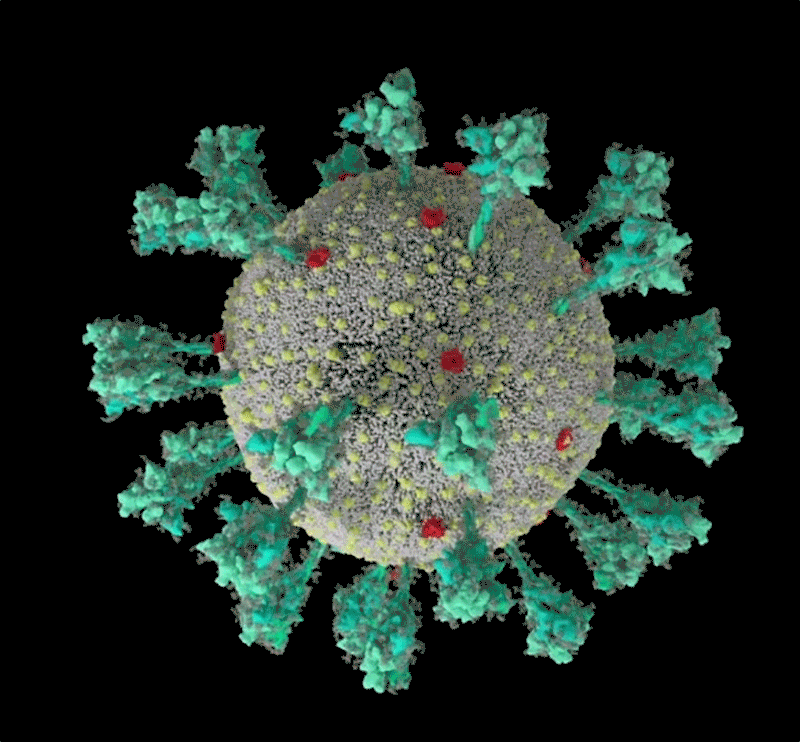
Protein gai của SARS-CoV-2 được bao phủ bởi các phân tử đường glycan. Cuống của nó có 3 điểm uốn giúp tăng độ linh hoạt. Ảnh: Lorenzo Casalino, UCSD, đồ họa: Nik Spencer/Nature
Như một số loại virus “sói đội lốt cừu” khác, các protein ngoài màng SARS-CoV-2 được bao phủ một lớp "bọc đường" glycan ngụy trang để trốn tránh hệ miễn dịch của con người. Lúc đầu các nhà sinh học cấu trúc còn chưa biết “cái móc” không được phủ glycan trên đầu protein gai được dùng để làm gì? Thì ra đó chính là “miền gắn thụ thể” (RBD), là một trong ba vị trí giúp virus “móc” vào tế bào người.
Theo mô phỏng của nhà sinh học Amaro tại đại học UCSD, khi “miền gắn thụ thể” trồi lên khỏi “đám đông” phân tử glycan để tiếp xúc với tế bào vật chủ, thì có ngay hai glycan sà vào khóa cố định “miền gắn thụ thể” để làm vững chắc liên kết với tế bào vật chủ vừa được thiết lập. Không chỉ Amaro, nhóm của nhà McLellan, nhà sinh học cấu trúc tại Đại học Texas-Austin, cũng thử làm đột biến phân tử glycan trên mô hình máy tính. Kết quả dẫn đến sự sụp đổ của “miền gắn thụ thể”, điều này gợi ý rằng nếu tìm ra giải pháp loại bỏ các cặp phân tử glycan nói trên sẽ làm giảm khả năng lây nhiễm của virus. Tuy nhiên, ý tưởng này vẫn chưa trở thành hiện thực.
Các nhà khoa học vẫn đang miệt mài tìm hiểu chi tiết về cách thức lây nhiễm của SARS-CoV-2, về khả năng thích ứng đáng kinh ngạc của virus bám và xâm nhập vào bên trong tế bào người, cũng như quá trình xử lý quan trọng của các hạt virus con để sau đó có thể tiếp xúc xâm nhiễm các tế bào khác.
Mở cửa, bám và bắt
Mỗi hạt virus SARS-CoV-2 được phủ 24-40 protein gai trên bề mặt. Khác với gai tương đối cứng của virus cúm, các gai của SARS-CoV-2 cực kỳ linh hoạt với cấu trúc khớp nối tại ba điểm. Điều này cho phép các gai xoay trở, lắc lư quét qua bề mặt tế bào để tìm kiếm vị trí thụ thể gắn kết. 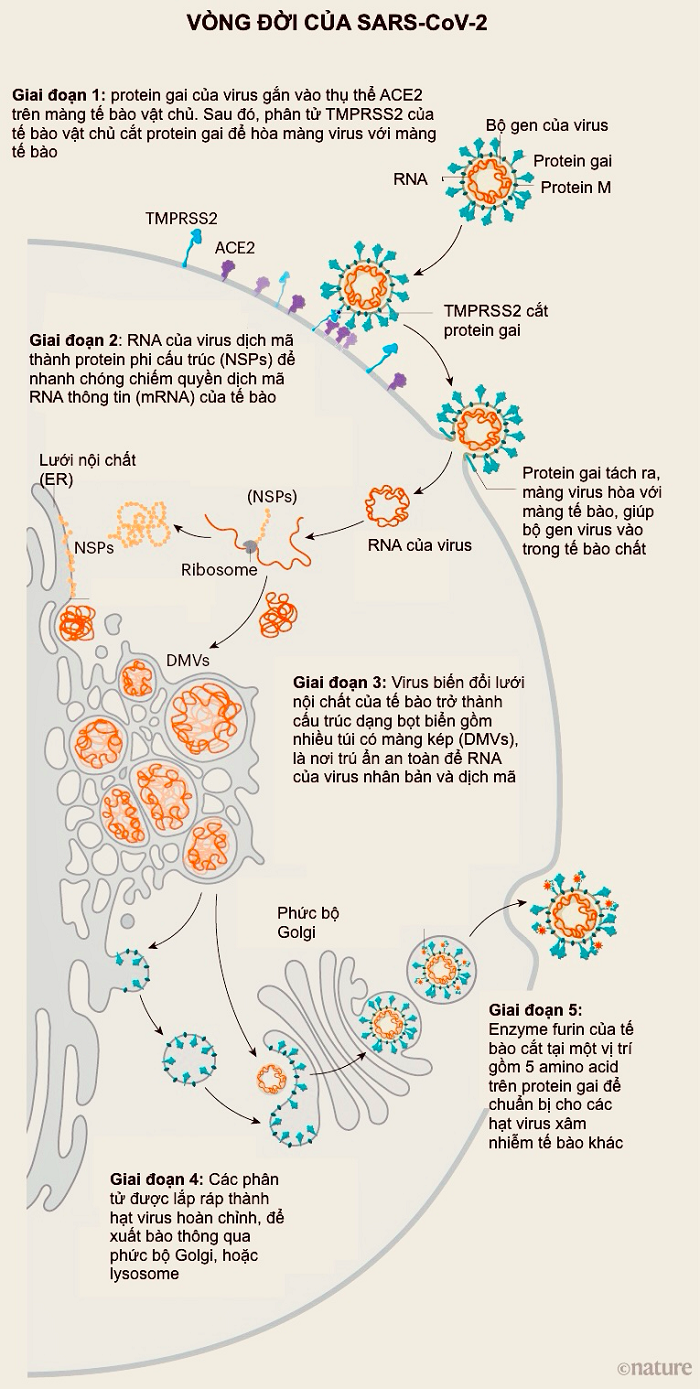
Nguồn: Hui (Ann) Liu, Univ. Utah; Đồ họa: Nik Spencer/Nature.
Ngay từ đầu đại dịch, các nhà nghiên cứu đã xác định được “miền gắn thụ thể” của SARS-CoV-2 gắn vào thụ thể ACE2 phổ biến trên màng tế bào phổi và hầu họng tương tự như SARS-CoV nhưng mạnh hơn 2-4 lần nhờ các hàng loạt các biến đổi cấu trúc giúp “miền gắn thụ thể” trở nên ổn định hơn.
Các biến thể đáng lo ngại của SARS-CoV-2 có xu hướng bị đột biến tại tiểu đơn vị S1 chứa “miền gắn thụ thể” (cũng như đột biến tại tiểu đơn vị S2 đóng vai trò giúp virus hòa màng xâm nhập tế bào).
Biến thể Alpha mang 17 thay đổi trong trình tự protein gai, khiến “miền gắn thụ thể” dễ dàng trồi lên để bám bắt thụ thể hơn, tăng khả năng lây nhiễm tế bào.
Biến thể Delta đang hoành hành khắp thế giới cũng mang nhiều đột biến tại tiểu đơn vị S1, bao gồm ba đột biến tại “miền gắn thụ thể”, giúp cải thiện khả năng liên kết với thụ thể ACE2 cũng như trốn tránh hệ miễn dịch.
Xâm nhập
Một khi virus bám được vào thụ thể ACE2, các protein khác của tế bào vật chủ sẽ kích hoạt một quá trình hòa màng giúp virus xâm nhập vào bên trong tế bào.
SARS-CoV sử dụng hai con đường xâm nhiễm tế bào khác nhau thông qua hai enzyme protease (men li giải protein): TMPRSS2 hoặc cathepsin L. SARS-CoV thường thông qua cathepsin L để xâm nhập tế bào, nhưng cũng thường bị protein kháng virus của tế bào bắt giữ.
Nhưng SARS-CoV-2 thì khác với SARS-CoV, nó sử dụng hiệu quả enzyme TMPRSS2 có số lượng lớn trên bề mặt tế bào hô hấp. TMPRSS2 cắt tiểu đơn vị S2, khiến amino acid kị nước của protein gai lộ ra và mau chóng vùi vào màng tế bào, tách màng tế bào ra như mở khóa kéo để màng virus hòa vào.
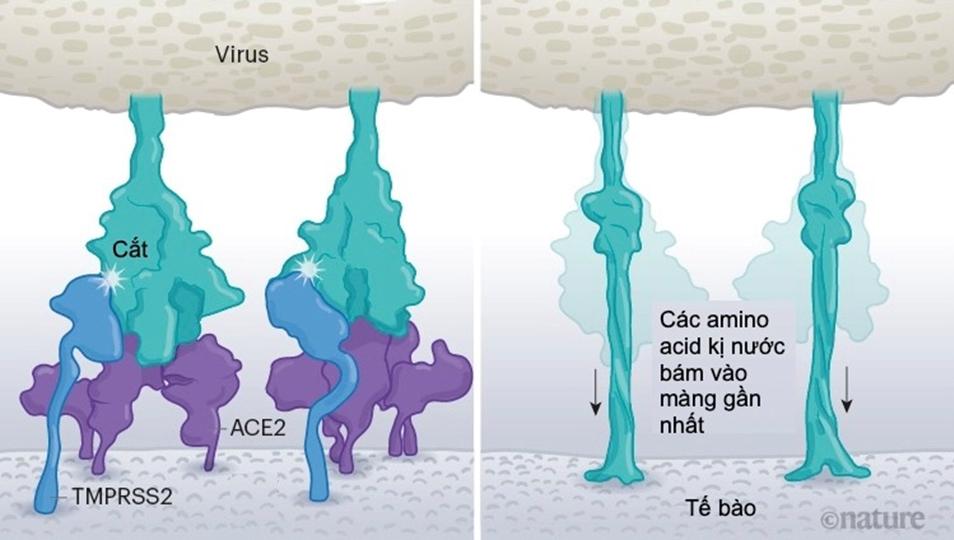
Một khi virus bám được vào thụ thể ACE2, các protein khác của tế bào vật chủ sẽ kích hoạt một quá trình hòa màng giúp virus xâm nhập vào bên trong tế bào. Source: Janet Iwasa, Univ. Utah; Graphic: Nik Spencer/Nature.
Nhờ cách này, bộ gene của virus SARS-CoV-2 có thể xâm nhiễm nhanh hơn mà không bị kẹt lại bên trong endosome như người anh em SARS-CoV của nó. Và đó cũng là lí do chloroquine không hiệu quả trong điều trị COVID mặc dù các nghiên cứu trong phòng thí nghiệm đạt kết quả hứa hẹn ban đầu. Một hoạt chất ức chế TMPRSS2 tên camostat mesylate, vốn được phê duyệt cho điều trị viêm tụy tại Nhật, được kì vọng sẽ ngăn chặn virus xâm nhập tế bào phổi, nhưng đáng tiếc cũng không giúp cải thiện kết quả điều trị trong thử nghiệm lâm sàng.
Không cho tế bào “vẫy cờ trắng”
Khi bộ gene RNA của virus đi vào tế bào chất, hai đoạn RNA của virus sẽ được dịch mã thành các chuỗi amino acid dài, sau đó được cắt thành 16 protein, nhằm tổng hợp RNA mới. Nhiều RNA mới sẽ tiếp tục dịch mã tổng cộng 26 protein của virus, bao gồm protein gai và protein phụ trợ. Bằng cách nào virus lợi dụng bộ máy của tế bào vật chủ để nhân bản hàng loạt bộ gene và các protein cần thiết.
Đầu tiên, virus loại bỏ sự cạnh tranh: ngay khi vào tế bào chất, RNA virus dịch mã ngay protein phi cấu trúc NSP1. Nó băm nát tất cả RNA thông tin (mRNA) của tế bào người (không có đuôi nhận dạng là RNA của virus) một cách có hệ thống. Tiếp đó, virus giảm 70% tổng hợp protein của tế bào.
Cuối cùng, virus tắt hệ thống cảnh báo của tế bào, theo nhiều cách khác nhau. Nhóm của Stern-Ginossar tại viện khoa học Weizmann, Israel, đã làm rõ được một cách trong số đó: virus ngăn cản mRNA rời khỏi nhân để phát tán cảnh báo miễn dịch. Một nhóm khác đã xác nhận cơ chế này, và lại một lần nữa chỉ ra rằng chính NSP1 đã chẹn đường thoát ra khỏi nhân của mRNA.
Không thể sản sinh nhiều phân tử interferon đóng vai trò đưa ra các tín hiệu cảnh báo “vẫy cờ trắng” báo hiệu nguy kịch, nên tế bào không thể phát tín hiệu cho đội quân miễn dịch về sự hiện diện của virus. Nhìn chung, SARS-CoV-2 làm điều này đặc biệt hiệu quả so với SARS-CoV hoặc RSV. Nghiên cứu mới đây cho thấy biến thế Alpha thậm chí còn hiệu quả hơn nữa trong cơ chế này.
Vì thế, khi hệ miễn dịch nhận ra cơ thể bị nhiễm virus thì tải lượng của chúng đã quá lớn. Khi đó các protein đáp ứng miễn dịch tràn vào máu gây ra thiệt hại nặng nề.
Mô phỏng cách thức hòa màng của SARS-CoV-2 với tế bào. Nguồn: Janet Iwasa, ĐH Utah.
Chiếm và tân trang nhà mới
Một khi chiếm được quyền dịch mã, tức là biến tế bào thành nhà riêng, lũ virus cải tạo tế bào phục vụ nhu cầu của mình. Một số protein gai của hạt virus mới sẽ trồi lên bề mặt tế bào để gắn thụ thể ACE2 của tế bào lân cận, tiến hành hòa màng hợp nhất tế bào nhiễm bệnh với tế bào lành, và có thể phát triển thành hợp bào khổng lồ chứa 20 nhân từ một cụm 20 tế bào.
Nhà sinh học phân tử Mauro Giacca tại King’s College London đã phát hiện ra hiện tượng này, đặt giả thuyết rằng hợp bào là nơi trú ẩn lâu dài để nhân bản số lượng các hạt virus. “Chúng không đánh rồi bỏ chạy, mà muốn bám trụ trường kì.”
Bên trong tế bào chất, SARS-CoV-2 biến lưới nội chất mỏng dẹt thành các khối dạng bọt biển gồm nhiều túi màng kép hình cầu (DMV), có vẻ như đây là nơi trú ẩn an toàn cho RNA của virus được sao chép và dịch mã, được che chắn khỏi sự tấn công của các thụ thể miễn dịch nội bào.
Hầu hết các virus xuất bào bằng cách lấy một phần màng tế bào làm lớp bao bọc – nôm na là chúng “ăn cắp” màng tế bào làm thành chiếc áo mặc. Tuy nhiên, coronavirus sử dụng cách thức khác biệt. Chúng lợi dụng phức bộ Golgi - vốn là nơi đóng gói các thành phần của tế bào - làm bưu cục vận chuyển chúng ra khỏi tế bào. Nhưng kể cả có chặn bưu cục Golgi thì chúng vẫn xuất bào thành công thông qua lysosome. Protein của virus tạo cho mình vỏ bao bằng cách nảy chồi vào lưới nội chất, rồi chiếm lấy lysosome để xuất bào. Vì thế giờ đây các nhà nghiên cứu đang thử nghiệm các hoạt chất ức chế lysosome như một giải pháp kháng virus tiềm năng.
Thực ra xuất bào thông qua phức bộ Golgi hoặc lysosome chậm và kém hiệu quả hơn cách thức thông thường nhưng các nhà khoa học vẫn chưa biết tại sao SARS-CoV-2 lại ưa thích cơ chế này. Phải chăng thành phần vỏ lipid của phức bộ Golgi hoặc lysosome phù hợp hơn với virus so với màng tế bào? Làm rõ được điều này có thể mở ra cơ hội cho các liệu pháp kháng virus mới.
Lát cắt cuối cùng
Trong khi các coronavirus khác chỉ có duy nhất một amino acid arginine (Arg) tại điểm nối hai tiểu đơn vị S1 và S2 thì SARS-CoV-2 có một chuỗi 5 amino acid Pro-Arg-Arg-Ala-Arg. Một protein của tế bào là furin nhận diện và cắt chuỗi amino acid này, và diện cắt furin đóng vai trò thiết yếu để virus xâm nhập tế bào phổi của người một cách hiệu quả. Nếu những con chồn nhiễm SARS-CoV-2 bị mất diện cắt furin, chúng thải ra nồng độ virus thấp hơn và mất khả năng truyền bệnh. Các virus cúm gia cầm độc lực cao cũng có diện cắt furin tương tự. Nghiên cứu tại Hà Lan cũng cho thấy cho thấy virus có diện cắt furin nguyên vẹn xâm nhập tế bào hô hấp của người nhanh hơn.
Sau khi được lắp ráp hoàn chỉnh, hạt virus mới cần phải náu trong các bào quan để tắm mình trong protease furin, nhà nghiên cứu Tom Gallagher tại Đại học Loyola đặt ra giả thuyết.
Nếu không có sẵn diện cắt furin làm lỏng lẻo liên kết giữa tiểu đơn vị S1 và S2, có lẽ virus sẽ bỏ qua con đường TMPRSS2 để bước vào quá trình nhập bào endosome.
Hai biến thể Alpha và Delta đã thay đổi diện cắt furin so với SARS-CoV-2 ban đầu: Proline được thay bằng Histidine (biến thể Alpha) hoặc Arginine (biến thể Delta) khiến chuỗi acid amin có tính kiềm hơn, dễ nhận diện để cắt hơn.
Nhiều diện cắt furin cũng đồng nghĩa càng nhiều protein gai làm mồi khởi đầu sự xâm nhiễm tế bào. Tỉ lệ protein gai mồi của SARS-CoV là 10%, còn SARS-CoV-2 là 50%, thậm chí lên đến 75% đối với biến thể Delta.
Những điều còn chưa biết
Số lượng thụ thể ACE2 cần thiết để gắn với mỗi protein gai, và chính xác khi nào thì tiểu đơn vị S2 bị cắt bởi TMPRSS2, và số lượng protein gai cần thiết cho sự hòa màng virus-tế bào. Hồi tháng 4/2020, một nhóm từ Đại học UCSF đã xác định được tới 332 tương tác giữa SARS-CoV-2 với protein người.
Thật khó để bắt kịp với tốc độ biến đổi của virus. Chúng ta vẫn chưa rõ bằng cách này Delta nhân bản nhanh và nhiều hơn so với các biển thể trước.
Điều may mắn là hầu hết các đột biến cho đến nay đều làm tăng khả năng lây lan hơn là tăng độc lực của virus. Riêng biến thể Delta đã làm tăng tải lượng virus trong cơ thể người nhiễm một cách nhanh chóng. Nhưng điều quan trọng là các loại vaccine hiện nay đều giữ được hiệu quả tương đối cao trước các biến thể, kể cả Delta.□