Giới thiệu
Sâm Việt Nam (SVN) có tên khoa học là Panax vietnamensis Ha & Grushv. là một trong 12 loài thuộc chi Nhân sâm (Panax), họ Ngũ gia bì (Araliaceae) được phát hiện lần đầu trong tự nhiên ở vùng núi Ngọc Linh thuộc tỉnh Kon Tum và Quảng Nam vào năm 1973 và được chính thức ghi nhận đầy đủ về mặt định danh thực vật học năm 1985 [1]. Ban đầu SVN được tìm thấy ở vùng núi Ngọc Linh thuộc hai tỉnh Kon Tum và Quảng Nam nên còn được gọi là sâm Ngọc Linh, Sâm K5 (Hình 1A). Đây là loài sâm thuộc chi Panax phân bố xa nhất về phía nam thuộc vùng nhiệt đới, so với các loài Panax khác chỉ thấy có đến vùng núi phía bắc Việt Nam [2-4]. Phần thân rễ (rhizome) của SVN phát triển, có nhiều đốt, mỗi đốt tương ứng cho một năm sinh trưởng nên còn được gọi là sâm đốt trúc (Hình 1B). Cùng với rễ thường nhỏ hơn, thân rễ là phần mang lại giá trị sử dụng chính của SVN. Các loài sâm (Panax) nổi tiếng khác như sâm Triều Tiên (STT, P. ginseng), sâm Mỹ (SM, P. quinquefolium) và sâm tam thất (TT, P. notoginseng) có đặc trưng với phần rễ củ sâu dưới đất, phình to và là phần có giá trị nhất của các loài này. Kể từ khi được phát hiện và ghi nhận là một loài Panax mới, SVN đã được sự quan tâm nghiên cứu về phân loại thực vật của các nhà khoa học trên thế giới học [5-8], khẳng định chắc chắn là một loài thực vật mới.
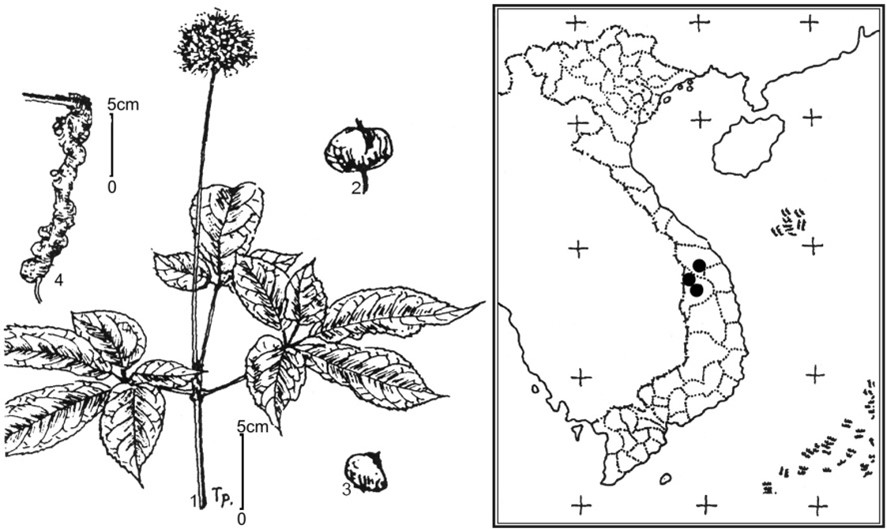
A

B
Hình 1. Cây sâm Việt Nam (P. vietnamensis Ha & Grushv)
A: ảnh vẽ cây sâm Việt Nam và vùng phân bố tự nhiên (nguồn http://www.botanyvn.com)
B: ảnh vẽ cây sâm Việt Nam [3].
SVN đã được người dân địa phương dân tộc Xê Đăng sử dụng từ lâu đời như là loại thuốc bổ với tên gọi thuốc giấu [2]. Đến nay cũng đã có nhiều nghiên cứu về thành phần hóa học và các tác dụng dược lý của SVN, tuy nhiên nếu so sánh với các loài sâm nổi tiếng khác thì các nghiên cứu về SVN vẫn còn ít hơn rất nhiều so với các loài STT, SM và TT (cơ sở dữ liệu PubMed: https://www.ncbi.nlm.nih.gov/pubmed). Bài báo này tổng hợp ngắn gọn kết quả nghiên cứu chính về thành phần hóa học saponin và tác dụng sinh học của SVN, có so sánh tổng quan với các loài Panax khác nhằm làm rõ được giá trị của dược liệu quý hiếm này.
Thành phần hóa học của sâm Việt Nam
Thành phần saponin
Thành phần saponin là thành phần hóa học chính, cũng được xem là thành phần hoạt chất chính giải thích cho các tác dụng sinh học của các loài Panax nói chung nên còn được gọi là ginsenosid. Cũng giống nhiều loài Panax khác, ginsenosid của SVN là các saponin triterpen có khung dammaran hoặc olean, được phân loại theo cấu trúc hóa học của phần sapogenin (phần triterpen). Các ginsenosid damaran trong chi Panax được chia làm các phân nhóm khác nhau gồm cấu trúc protopanaxadiol (PPD, có gắn đường tại 3-OH và 20-OH), protopanaxatriol (PPT, có gắn đường tại 6-OH và 20-OH), ocotillol (OT, đóng vòng 5 cạnh gắn tại C-17), ngoài ra còn saponin thuộc khung olean (OA) là dẫn xuất của acid oleanolic. Các nghiên cứu trước về hóa thực vật của SVN tập trung vào các mẫu sâm mọc tự nhiên, và phần dưới mặt đất là thân rễ, rễ củ và rễ (bộ phận được sử dụng chính). Đến nay, tổng cộng có 52 hợp chất saponin/ginsenosid được phân lập và xác định cấu trúc hóa học đầy đủ từ SVN, chủ yếu là saponin khung dammaran, đa dạng các nhóm thế và các vị trí gắn đường, thuộc ba nhóm PPD (23 chất, 1-23, Hình 2a), PPT (17 chất, 24-40, Hình 2b) và OT (10 chất, 41-50, Hình 2c); ngoài ra có 2 chất có khung OA là ginsenoside Ro (51) và hemsloside Ma3 (52) (Hình 2d) [7-11]. Phân tích thêm thì thấy rằng trong số 52 saponin, có 26 saponin có cấu trúc mới khi lần đầu phân lập được từ SVN được đặt tên là vinaginsenoside R1-R25 (VR1~VR25) và 20-OMe-G-Rh1, các hợp chất này cho đến nay chưa được phân lập từ loài Panax nào khác cũng như từ thiên nhiên ngoài SVN; các saponin khung OT có cấu trúc độc đáo với vòng furan ở mạch nhánh C-17 và từ các loài Panax cho đến nay có 15 saponin khung OT được xác định trong 4 loài P. vietnamensis, P. japonicus, P. quinquefolium và P. pseudoginseng. Riêng từ SVN có 10 saponin khung OT và đóng góp 5 saponin OT lần đầu tiên phân lập (VR1, VR2, VR5, VR6, VR14) [12].
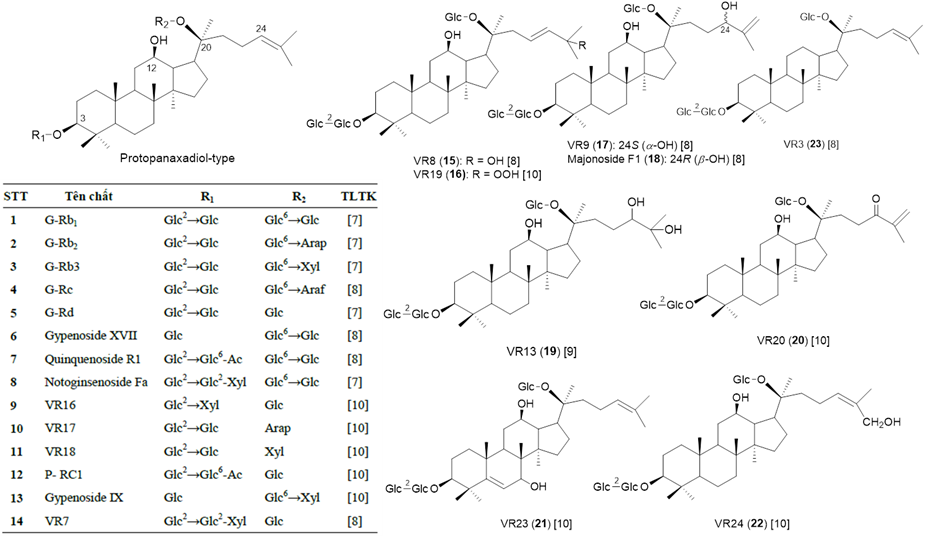
Hình 2a. Các ginsenosid khung PPD trong SVN
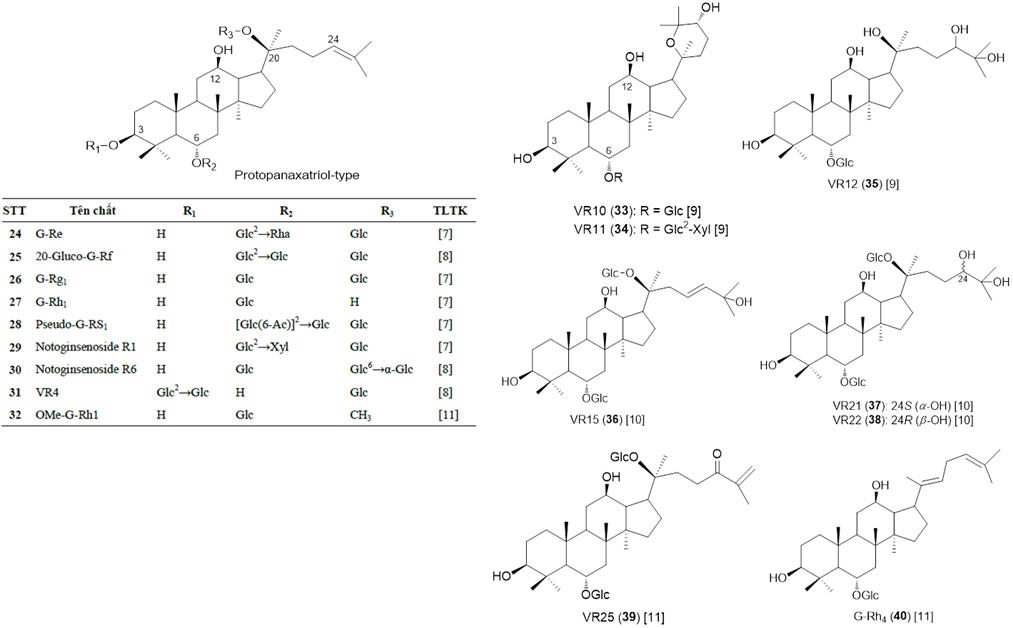
Hình 2b. Các ginsenosid khung PPT trong SVN
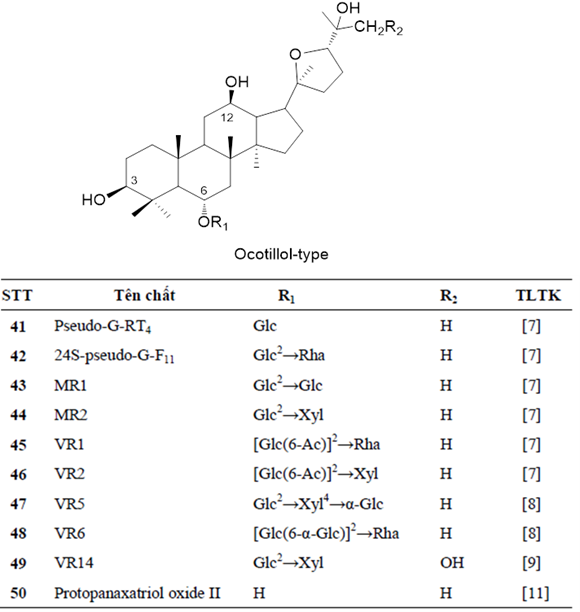
Hình 2c. Các ginsenosid khung OT trong SVN
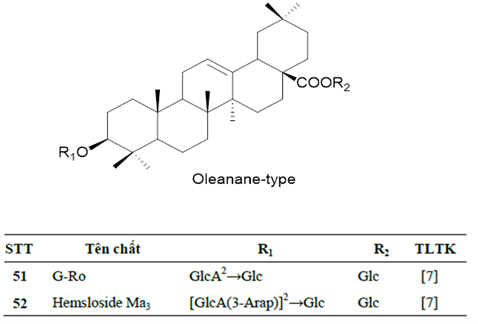
Hình 2d. Các ginsenosid khung OA trong SVN
Ginsenosid có hàm lượng lớn nhất là majonoside R2 (MR2, chất số 44, hàm lượng ~5%), tiếp theo là ginsenoside Rb1 (G-Rb1, 1, ~2%), và Rg1 (G-Rg1, 26, ~1,37%) [13]. Ba chất này cùng với các chất chính khác Rb2 (G-Rb2, 2), Rd (G-Rd, 5), Re (G-Re, 24), majonoside R1 (MR1, 43), notoginsenoside R1 (NR1, 29), vinaginsenoside R1 (VR1, 45), vinaginsenoside R2 (VR2, 46) và vinaginsenoside R11 (VR11, 34) chiếm trên 90% hàm lượng saponin tổng số [13].
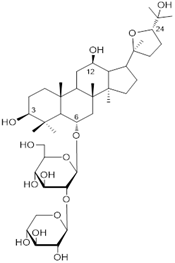
Hình 4. Majonosid R2 (MR2, 44), ginsenosid chính của SVN
Để so sánh thành phần saponin của SVN với một số loài Panax phổ biến, Bảng 1 tổng hợp tài liệu tham khảo về hàm lượng saponin, số lượng các hợp chất saponin, saponin chủ yếu, cấu trúc của các saponin của SVN và của 5 loài Panax khác. Hàm lượng saponin toàn phần của SVN rất cao, có thể đến 10% trong SVN tự nhiên. Về số lượng các hợp chất saponin (ginsenoside) trong SVN cũng nhiều nhất, tới 52 chất, có các cấu trúc thuộc các nhóm PPD, PPT, OT và OA, cũng đa dạng nhất trong số các loài Panax. Điều đặc biệt là SVN có chứa nhóm ginsenosid OT, trong đó các chất MR1, MR2, VR1 và VR2 chiếm trên 50% hàm lượng saponin tổng số, riêng thành phần MR2 là chất chính, có hàm lượng lên đến 5% tính theo khối lượng khô [13]. Trong khi đó các loài Panax khác không có saponin thuộc nhóm OT, chỉ duy nhất có SM và SNB chứa một hàm lượng nhỏ [12], [13]. Như vậy, khác biệt của SVN so với các loài Panax khác là thành phần saponin chính thuộc nhóm OT, trong đó có một số chất chỉ tìm thấy trong loài này như MR1, MR2, VR1, VR2… Để minh họa về thành phần saponin có trong sâm VN, Hình 3A là dấu vân tay sắc ký HPLC của các thành phần ginsenoside chính trong SVN [14],[15], còn Hình 3B là hình ảnh sắc ký TLC của các thành phần ginsenoside chính trong SVN có so sánh với một số loài Panax khác ở cùng điều kiện, nồng độ dịch chiết từ dược liệu khi chấm sắc ký. Những kết quả thu được về thành phần hóa học có ý nghĩa rất quan trọng, góp phần khẳng định về phân loại học rằng SVN là một loài mới [5], [6], [21] và định hướng cho nghiên cứu và đánh giá về giá trị của SVN.
Bảng 1. Thành phần saponin/ginsenosid của phần dưới mặt đất của một số loài Panax*
|
Saponin/ Ginsenosid |
SVN |
STT |
TTB |
SNB |
SM |
SVD |
TTH |
|
Saponin tổng số (%, kl/kl)* |
~10,0 |
3,8-5,2 |
6-8 |
5.2 |
4-6 |
(-) |
(-) |
|
Số hợp chất saponin/ginsenoside đã biết |
52 |
70 |
153 |
28 |
65 |
10 |
15 |
|
Nhóm cấu trúc của saponin (PPD, PPT, OT, OA) |
OT, PPT, PPD, OA |
PPT, PPD, OA |
PPD, PPT, OT |
PPD, PPT, OA, OT |
PPD, PPT, OT, OA |
OA |
OA |
|
Ginsenosid chính (có hàm lượng lớn nhất) |
MR2 (~5%) |
Rb1 |
NR1 |
Chikusetsusaponin V |
Rb1 |
Pseudoginsenoside RT1 |
Stipuleanoside R1 methyl ester |
|
Các ginsenosid khác có hàm lượng cao |
Rg1, Rb1 |
Rg1, Re, Rb2, Rd, Rb2, Rc |
Rg1, Rb1, Rd, Re |
Chikusetsusaponin IV, Rb1, Re, Rc |
Re, Rd, Rc, Rg1 |
Stipuleanoside R2 methyl ester |
Stipuleanoside R2 methyl ester |
|
Hàm lượng ginsenosid nhóm OT |
Là thành phần chính; (>50% tổng saponin) |
Không có |
Rất nhỏ |
Nhỏ |
Rất nhỏ |
Không có |
Không có |
|
Số các hợp chất ginsenosid OT đã biết |
10 |
0 |
4 (không có MR2) |
5 (có MR2) |
4 (không có MR2) |
0 |
0 |
* Hàm lượng được xác định trong các loài Panax 6 năm tuổi. SVN (P. vietnamensis) [12-16]; STT: sâm Triều Tiên (P. ginseng) [12],[17]; SM: sâm Mỹ (P. quinquefolius) [12,17]; TTB: Tam thất bắc (P. notoginseng) [12],[18], SVD: sâm vũ diệp (P. bipinnatifidus) [12],[19] và TTH: tam thất hoang (P. stipuleanatus) [12],[20]; (-): chưa có số liệu về hàm lượng saponin toàn phần và các saponin nhóm OT trong SVD và TTH.
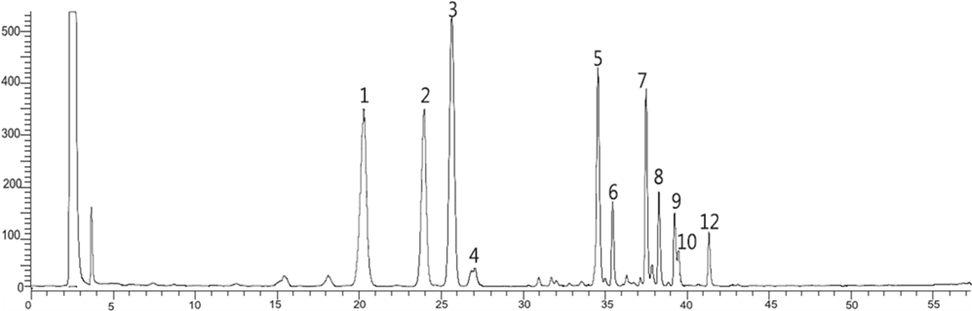
Hình 3A. Sắc ký đồ HPLC-ELSD của cao chiết tổng SVN và dấu vân tay sắc ký của các thành phần saponin/ginsenosid chính. Điều kiện sắc ký và quy trình phân tích theo tài liệu tham khảo [14]. Các chất tương ứng là 1: MR1; 2: Rg1+Re; 3: MR2; 4: chưa xác định; 5: VR1+VR2; 6: chưa xác định; 7: Rb1; 8: Rc; 9: Rh2; 10: Rh1; 12: Rd.
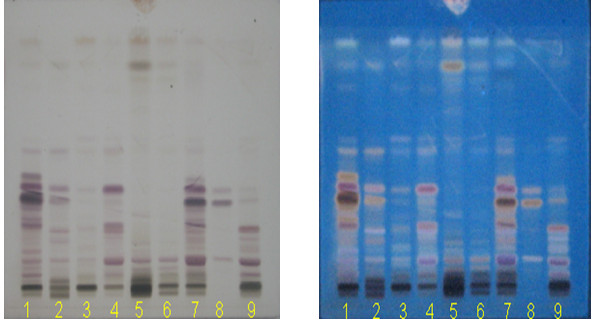 Hình 3B. Sắc ký đồ TLC của cao chiết ethanol SVN và một số loài Panax khác. Điều kiện sắc ký và quy trình phân tích theo tài liệu tham khảo [12]. 1: SVN tự nhiên (tại Ngọc linh); 2: SVN trồng tại Ngọc Linh 3 năm tuổi; 3: Sâm Triều Tiên (STT); 4: Tam thất bắc (TTB); 5: Tam thất hoang (TTH); Sâm vũ diệp (SVD); 7: Sâm Lai Châu (SLC); 8: Hỗn hợp các chất chuẩn Rg1, MR2, Rb1 (từ trên xuống); 9: Sâm Mỹ.
Hình 3B. Sắc ký đồ TLC của cao chiết ethanol SVN và một số loài Panax khác. Điều kiện sắc ký và quy trình phân tích theo tài liệu tham khảo [12]. 1: SVN tự nhiên (tại Ngọc linh); 2: SVN trồng tại Ngọc Linh 3 năm tuổi; 3: Sâm Triều Tiên (STT); 4: Tam thất bắc (TTB); 5: Tam thất hoang (TTH); Sâm vũ diệp (SVD); 7: Sâm Lai Châu (SLC); 8: Hỗn hợp các chất chuẩn Rg1, MR2, Rb1 (từ trên xuống); 9: Sâm Mỹ.
Các kết quả nghiên cứu về SVN trồng và nuôi cấy cũng cho biết chúng có hàm lượng saponin rất cao, thành phần chủ yếu là ginsenosid có khung OT mà thành phần chính là MR1 và MR2. Tuy nhiên, các saponin tìm thấy trong SVN trồng và nuôi cấy vẫn trong số 52 thành phần đã được tìm thấy trong SVN mọc tự nhiên [2], [14], [22].
Nghiên cứu phân tích thành phần saponin trong các phần/bộ phận khác nhau của phần dưới mặt đất của SVN thiên nhiên bao gồm thân rễ, rễ củ và rễ con cho thấy hàm lượng saponin phần thân rễ là cao nhất với 195 mg/g và bộ phận rễ củ và rễ con lần lượt là 156 và 139 mg/g. Nhóm saponin cấu trúc khung OT là thành phần chính chiếm 36-75% lượng saponin tổng số và tỷ lệ hàm lượng các nhóm cấu trúc của khung PPT:PPD:OT của thân rễ, rễ củ và rễ con lần lượt là 1:1,7:7,8, 1:1,6:5,5 và 1:4,8:3,3 [14].
Nhân sâm mà điển hình là sâm TT (P. ginseng) được dùng nhiều và phổ biến hơn dưới các dạng chuyển hóa qua quá trình chế biến (hấp, lên men) để thu được hồng sâm, hắc sâm,….mà cơ sở khoa học chính là sự biến đổi của các thành phần hoạt chất ginsenosid làm tăng tác dụng dược lý bao gồm tăng cường miễn dịch, chống oxi hóa và ung thư. Với SVN thì nghiên cứu về các dạng chế biến mô phỏng như vậy mới bắt đầu được nghiên cứu và trên nguyên liệu SVN được hấp cách thủy cho thấy hàm lượng các thành phần ginsenoside như Rb1, Rc, Rd, Re và Rg1 giảm do chuyển hóa, biến đổi cấu trúc hóa học theo cơ chế thủy phân tách loại các phân tử đường ở các vị trí C-3,6,20 và phân tử nước thành các ginsenoside ít phân cực hơn như Rg3, Rg5, Rk1, Rk3 và Rh4 tương tự như sâm TT. Tuy nhiên, thành phần ginsenosid có khung OT như MR1 và MR2 với đặc điểm cấu trúc không mang các phân tử đường ở C-20 có hàm lượng không thay đổi dưới tác dụng của quá trình hấp thường quy [15,16].
Các thành phần hóa học khác
Ngoài thành phần chính saponin, trong SVN còn có các thành phần gồm polyacetylen, các sterol, amino acid, acid béo, các nguyên tố vi lượng, đường tự do [2]. Có 18 acid amin cũng đã được phát hiện trong thành phần của sâm Ngọc Linh bằng phương pháp sắc ký lỏng (HPLC), trong đó có 8 acid amin thiết yếu [2], [3]. Các acid amin có tỷ lệ cao là arginin, lysin, và trytophan. Các acid béo có trong SVN được tìm thấy như acid palmetic, acid stearic, acid oleic, acid linoleic, acid linolenic [2], [3]. Bảy hợp chất polyacetylen đã được phân lập ở phân đoạn ít phân cực từ phần dưới mặt đất của SVN [3]. Cùng với saponin, polyacetylen là nhóm hợp chất hay gặp trong trong các loài Panax và Araliaceae khác [12].
Tác dụng sinh học của SVN và các hợp chất của SVN
Tác dụng bổ dưỡng, tăng cường sức khỏe, kích thích miễn dịch
Theo công dụng trong y học truyền thống, SVN được sử dụng như một vị thuốc bổ để tăng cường thể chất và phục hồi sức khỏe khi điều trị các loại bệnh, chống suy nhược cơ thể, chống mệt mỏi, tự điều hòa của cơ thể [23-25].
Cũng giống nhiều loài Panax khác, ginsenosid của SVN là các saponin triterpen có khung dammaran hoặc olean, đã được minh chứng đóng vai trò như là chất chủ vận (agonist) đối với các thụ thể của steroid bao gồm cả hormone steroid, có thể đây cũng là một cơ chế đóng góp vào khả năng điều hòa, ổn định môi trường nội sinh với biến đổi của môi trường hay tăng sức chịu đựng của cơ thể [17]. Tác dụng bổ dưỡng, chống suy nhược được tổng hợp qua thực tế sử dụng theo các bài thuốc bổ chứa SVN, tác dụng tổng hợp trên lâm sàng này có liên quan nhiều đến các tác dụng dược lý chuyên biệt khác như trên thần kinh trung ương hay trên chức năng gan sẽ được tổng hợp trong các phần dưới đây.
Tác dụng trên thần kinh trung ương
Tác giả Nguyễn Thị Thu Hương và cộng sự cho thấy tác dụng của cao SVN và hợp chất MR2 làm tăng phản xạ và nhận biết của chuột suy nhược thần kinh qua tác dụng kích thích hoạt động của thần kinh trung ương [26-28].
Khi dùng SVN và MR2 dự phòng thể hiện tác dụng làm giảm hay ức chế sự kém nhận biết về cảm nhận đau gây ra bởi suy nhược. Theo cơ chế, flumazenil và picrotoxin làm triệt tiêu tác dụng đối kháng của MR2 trên thụ thể giảm đau opioid, từ đó minh chứng là MR2 ức chế sự làm giảm quá trình thu nhận cảm giác bất ổn gây ra bởi suy nhược gắn liền với tham gia hoạt động của các thụ thể opioid ở thần kinh trung ương [29-31]. Mô hình tương tự với tác nhân gây giảm hoạt động nhận thức khác là diazepam, naloxone hay dẫn xuất barbital cũng cho kết quả tương tự. Về mặt cơ chế có thể giải thích cho tác dụng của MR2 đó là MR2 hoạt động như là chất đối kháng trên thụ thể của GABA đặc hiệu với các benzodiazepine [27,32]. Các kết quả thực nghiệm thu được đã minh chứng cho tác dụng chống suy nhược của cao chiết SVN và hoạt chất chính MR2 trong các mô hình trên chuột suy nhược, tổn thương thần kinh và suy nhược cơ thể [33].
Tác dụng chống ung thư
Tác dụng chống ung thư của SVN được quan tâm nghiên cứu nhiều nhất và các kết quả cho thấy SVN, cả cao chiết và thành phần tinh chế được, thể hiện tác dụng theo hướng phòng ngừa và trị liệu ung thư trên mô hình in vitro và in vivo và liên quan đến thành phần đặc trưng của SVN là các ginsenoside nhóm OT bao gồm majonosid R2 (viết tắt là MR2), có cấu trúc trong Hình 3.
Trong một nghiên cứu của các nhà khoa học Viêt Nam và Nhật Bản, tác giả Yamasaki và cộng sự công bố cao chiết SVN và thành phần saponin chính (MR1, MR2, G-Rb1, G-Rb2, G-Rd, G-Re, G-Rg1) thể hiện ức chế sự hoạt hóa của yếu tố phát triển khối u Epstein-Barr virus early antigen (EBV-EA) kích thích bởi độc tố gây ưng thư 12-O-tetradecanoylphorbol-13acetate (TPA) và fumonisin B1 [34]. Đáng chú ý là thành phần chính của SVN, MR2 có hoạt tính mạnh nhất trong các ginsenoside chính và tác dụng ức chế mạnh hơn chất chuẩn dương là glycyrrhetic acid có nguồn gốc từ cây cam thảo (Glycyrrhiza uralensis) [35]. Minh chứng khác trên mô hình in vivo, MR2 ức chế sự hình thành và phát triển khối u da kích thích bởi 7,12-dimethylbenz[a]anthracene/TPA, nitric oxide (NO)/TPA và peroxynitrite/TPA và u gan gây ra bởi N-nitrosodiethylamine/phenobarbital [36].
Nghiên cứu gần đây của tác giả Nguyễn Minh Đức và cộng sự, dịch chiết SVN có tác dụng gây độc tế bào ung thư phổi A549 và tác dụng ức chế này mạnh hơn rõ rệt với mẫu SVN sau khi hấp. Tác dụng gây độc tế bào mạnh hơn được cho là có sự liên hệ với sự chuyển hóa của các ginsenoside do sự ảnh hưởng của nhiệt hấp làm thủy phân các phân tử đường và tách loại các đơn vị nước trong phân tử ginsenoside tự nhiên tạo ra các ginsenoside ít phân cực như Rg3, Rg5, Rk1, Rk3 và Rh4 [15], [16].
Bên cạnh đó, cơ chế tế bào của tác dụng gây chết tế bào ung thư đã được nghiên cứu và cho thấy MR2 ức chế chu trình tế bào ung thư ở giai đoạn S và G2+M [34], [36]. Tổng hợp các minh chứng cho thấy MR2, thành phần saponin chính của SVN, có tiềm năng phát triển thành hoạt chất trong hóa trị liệu điều trị ung thư.
Tác dụng bảo vệ gan
Một tác dụng sinh học khác của SVN đã được nghiên cứu và minh chứng là tác dụng bảo vệ gan trên cả mô hình nuôi cấy tế bào in vitro và mô in vivo.
Năm 2000, tác giả Nguyễn Minh Đức và cộng sự thấy rằng cao chiết SVN có tác dụng bảo vệ tế bào gan ở chuột nhắt gây ra bởi CCl4 [37]. Trong nghiên cứu tiếp theo, tác giả Trần Lê Quân và cộng sự công bố tác dụng bảo vệ tế bào gan, chống hoại tử tế bào gan trên gây ra bởi độc tố D-GalN/TNF-α và tác dụng bảo vệ này đáp ứng bởi thành phần ginsenoside nhóm OT đặc trưng của SVN [11]. Thành phần ginsenoside chính MR2 thể hiện bảo vệ tế bào gan chuột qua biểu hiện giảm nồng độ men gan hoạt động gây ra bởi viêm gan, tổn thương gan là sGPT và sGOT; nghiên cứu này cũng chỉ ra rằng tác dụng bảo vệ tế bào gan theo cơ chế gây chết tự nhiên-apoptosis dựa trên bằng chứng về hình thái tế bào, sự phân mảnh DNA nhân tế bào và ngưng tập chromatin nhân tế bào [38].
Nghiên cứu xa hơn cũng chỉ ra rằng MR2 có tác dụng làm giảm chất chỉ thị của quá trình viêm, tổn thương gan, tế bào gan là TNF-α và có khả năng tái tạo tế bào gan [38]. Các kết quả nghiên cứu có được có thể khẳng định tác dụng bảo vệ gan và tế bào gan, chống lại các độc tố gây hại tới gan và tăng sinh tái tạo tế bào gan.
Các tác dụng khác
SVN ngoài tự nhiên ngày càng cạn kiệt, gần đây với sự thành công bước đầu trong các mô hình trồng thực nghiệm và nuối cây mô SVN, các tác dụng dược lý của các mẫu SVN mới này đã được nghiên cứu và các kết quả cho thấy SVN trồng thể hiện các tác dụng dược lý tương tự với SVN tự nhiên bao gồm tác dụng chống suy nhược cơ thể [39], [40], tác dụng trên hệ miễn dịch [41-43], tác dụng trên TKTW [44-48], tác dụng trên gan [49-51] và tác dụng trên hệ nội tiết [52]. Cụ thể như bột chiết SVN trồng có tác dụng kháng viêm mạn trên thực nghiệm gây u hạt bằng cách cấy bông cotton, có tác dụng giảm đau trên thực nghiệm gây đau xoắn bụng bằng acic acetic hay do đĩa nóng (hot-plate). Cơ chế tác dụng kháng viêm thể hiện thông qua tuyến yên-tuyến thượng thận, gia tăng hoạt động tăng tiết corticoid của tuyến thượng thận và tác động không còn trên chuột đã bị hủy tuyến yên [42].
Tác dụng dược lý chính của SVN tự nhiên được tổng hợp trong Bảng 2 dưới đây:
Bảng 2. Tổng hợp các tác dụng dược lý chính của SVN (P. vietnamensis)
|
STT |
Tác dụng dược lý |
Mô hình thực nghiệm |
Cơ chế tác dụng |
Mẫu nghiên cứu sử dụng |
TLTK |
|
1 |
Tác dụng bổ dưỡng, chống suy nhược và tăng cường sức khỏe |
- Theo tri thức y học cổ truyền - Mô hình động vật thực nghiệm trên chuột |
Tăng cường các chức năng của cơ thể: chức năng thần kinh TW, chức năng gan, chức năng tiêu hóa |
Cao chiết, MR2 |
[23-25] |
|
2 |
Tác dụng trên thần kinh trung ương |
Mô hình động vật thực nghiệm trên chuột |
- Tăng phản xạ thần kinh - Tác dụng trên thụ thể của thần kinh TW (thụ thể GABA, thụ thể opioid) - Chống oxi hóa, bảo vệ tế bào thần kinh |
Cao chiết, cao saponin, MR1,MR2, VR2 |
[26-33] |
|
3 |
Tác dụng chống ung thư |
- Tế bào ung thư thực nghiệm in vitro (Raji leukemia cells, A549 lung cancer cells) - Mô hình động vật thực nghiệm trên chuột |
- Phòng ngừa tác nhân hóa học gây ung thư và phát triển khối u-Chemoprevention - Ức chế sự phát triển của tế bào ung thư - Ức chế chu trình phân chia tế bào - Ức chế sự phát triển của khối u |
Cao chiết, các thành phần ginsenosid chính: G-Rb1, G-Re, G-Rg1, G-Rd, MR1 và MR2 |
[15], [16], [34-36] |
|
4 |
Tác dụng bảo vệ gan |
Mô hình động vật thực nghiệm trên chuột, tế bào gan chuột |
- Bảo vệ tế bào gan với các chất độc trên gan (paracetamol, CHCl3, CCl4, etanol, D-GalN/TNF-α) - Tăng sinh tế bào gan và gây chết theo chu trình tự nhiên apoptosis - Điều hòa men gan |
Cao chiết, MR2 |
[37], [38] |
Triển vọng phát triển sâm Việt Nam
Thành phần hóa học chính của SVN là các saponin, đã có tổng cộng 52 thành phần saponin/ginsenoside được phân lập và xác định từ bộ phận trên và dưới mặt đất (rễ và thân rễ) của SVN. Giống như một số loài Panax khác, các saponin chủ yếu thuộc nhóm damaran (50 trong số 52 chất), chỉ có 2 chất thuộc nhóm olean. Điểm khác biệt của loài P. vietnamensis so với các loài Panax khác là saponin damaran có khung ocotillol (OT) là thành phần saponin chính, chiếm hơn 50% saponin toàn phần. Trong đó, chất majororid R2 (MR2) là hợp chất chính, chỉ có trong SVN (và dưới loài là Sâm Lai Châu) có hàm lượng tới 4-5% (kl/kl). Thành phần hóa học của SVN qua chế biến và các bộ phận khác (lá, cành, hoa, hạt) cũng đã có nghiên cứu, nhưng còn ít và cần có thêm các nghiên cứu để khẳng định thành phần hóa học và tác dụng sinh học để định hướng cho việc ứng dụng. SVN cũng được chứng minh có nhiều tác dụng dược lý quí như tác dụng tăng cường sức lực, trí tuệ, giảm stress, chống suy nhược, chống ung thư, bảo vệ gan, chống oxy hóa... Cũng giống như các loài Panax khác, các tác dụng sinh học của SVN đã giải thích được cơ sở khoa học theo y dược học dân gian, cổ truyền về các công dụng của SVN mà còn định hướng phát triển thành các dạng bào chế mới cho điều trị bệnh trong y học hiện đại.
So với các loài sâm Panax khác thì số lượng các công bố nghiên cứu và các kết quả nghiên cứu về SVN (P. vietnamensis) theo các hướng nghiên cứu về hóa thực vật, dược học, chế biến, bào chế… là chưa nhiều và chưa đầy đủ. Trong bài báo này chúng tôi đã tổng hợp các kết quả công bố cập nhật về thành phần hóa học và các tác dụng sinh học chủ yếu của SVN. Các nghiên cứu về thành phần hóa học của SVN cho thấy thành phần chính là các saponin thuộc nhóm damaran, giống với các loài sâm (Panax) quí khác trên thế giới. Các kết quả nghiên cứu cũng cho thấy việc sử dụng SVN theo y học dân tộc và y học cổ truyền Việt Nam đúng như nghĩa latinh của từ “ginseng”, nghĩa là “trị tất cả các bệnh” hay “làm lành tất cả”. Do đó, có thể kết luận SVN là một nguồn gen đặc hữu và quí hiếm của đất nước, có khả năng phát triển thành nhiều sản phẩm phục vụ nhu cầu của con người. Ứng dụng của SVN không chỉ trong y học cổ truyền, trong y học hiện đại mà còn có thể ứng dụng trong cả thực phẩm và mỹ phẩm, do đó có thể có tác động lớn đến các vấn đề về y tế, kinh tế, thậm chí là văn hóa và xã hội.
Kể từ khi được phát hiện và ghi nhận là một loài Panax mới, loài sâm này đã được khai thác sử dụng ngay cho việc chăm sóc sức khỏe chiến sĩ và nhân dân trong khu giải phóng. Sau khi thống nhất đất nước, nhận thức được giá trị của loài sâm Panax mới, Việt Nam đã thành lập đơn vị nghiên cứu sâm (năm 1977) và Công ty dược liệu I Ngọc Linh (năm 1976) để bảo tồn, phát triển, và nghiên cứu để khẳng định giá trị loài sâm mới này. Tháng 9 năm 2017, Thủ tướng Chính phủ Việt Nam đã phê duyệt SVN là sản phẩm Quốc gia cùng với nhiều chương trình nghiên cứu và phát triển dược liệu quí hiếm này. Để phát triển nguồn gen dược liệu này, cần thiết phải có thêm nhiều các nghiên cứu khoa học, trong đó tập trung vào các lĩnh vực nhân giống, trồng trọt, thu hoạch, nâng cao chất lượng SVN. Các nghiên cứu cần thiết khác bào gồm bào chế các dạng sản phẩm khác nhau từ SVN như dược phẩm, thực phẩm, và mỹ phẩm. Hy vọng rằng cây SVN sẽ được phát triển toàn diện về mọi mặt để có đóng góp lớn cho sự nghiệp y tế, kinh tế, văn hóa, xã hội của đất nước và dân tộc Việt Nam.
Kết luận
Sâm Việt Nam (SVN) có tên khoa học là Panax vietnamensis Ha et Grushv., thuộc họ Ngũ gia bì (Araliaceae), phân bố đặc hữu ở vùng núi Ngọc Linh thuộc hai tỉnh Kon Tum và Quảng Nam, nên còn gọi là sâm Ngọc Linh, sâm K5. So với lịch sử sử dụng lâu dài và đã được nghiên cứu rất nhiều của các loài sâm Triều Tiên (P. ginseng), sâm Mỹ (P. quinquefolium) hay Tam thất (P. notoginseng) thì SVN được ghi nhận sử dụng theo kinh nghiệm của các dân tộc thiểu số và mới được nghiên cứu chủ yếu về hóa thực vật và tác dụng dược lý. Các nghiên cứu về hóa học cho thấy thành phần chính của SVN là có các saponin dammaran, điểm khác biệt so với các loài Panax khác là SVN thuộc nhóm ocotillol (OT) chiếm tới hơn 50% saponin toàn phần. Trong đó hợp chất chính của SVN là majorosid R2 có thu suất lên tới 50% (kl/kl saponin toàn phần) và là chất chỉ tìm thấy trong loài này. SVN và các hợp chất của nó đã được chứng minh có nhiều tác dụng dược lý quí như tác dụng tăng cường sức lực, trí tuệ, giảm stress, chống suy nhược, chống ung thư, bảo vệ gan, chống oxy hóa... Các nghiên cứu về tác dụng sinh học của SVN đã giải thích được cơ sở khoa học theo y dược học dân gian, cổ truyền về các công dụng của SVN mà còn định hướng phát triển thành các dạng bào chế mới cho điều trị bệnh trong y học hiện đại. Gần đây SVN đã được đưa vào danh mục sản phẩm quốc gia và ngày càng thu hút nhiều nghiên cứu với thông tin khoa học mới được công bố về thành phân hóa học và tác dụng sinh học của SVN. Các công bố về thành phần hóa học và tác dụng dược lý cập nhật cho đến nay của SVN đã thấy được giá trị của SVN không thua kém gì các loài sâm Panax khác trên thế giới.
Tuy còn có ít các nghiên cứu về thành phần hóa học và tác dụng dược lý của SVN, nhưng đã đủ để thấy được giá trị rất quan trọng của nguồn gen Panax vietnamensis không thua kém gì các loài sâm Panax khác trên thế giới. Bên cạnh các nghiên cứu cơ bản về hóa thực vật, tác dụng dược lý, các dạng sản phẩm bào chế thì việc nghiên cứu phát triển nguồn dược liệu SVN rất quan trọng để cung cấp đủ nhu cầu trong nước và hướng đến xuất khẩu.
Tài liệu tham khảo
1. Dung HT, Grushvisky IV (1985). A new species of the genus Panax, Araliaceae in Vietnam: Panax vietnamensis Ha et Grushv. Bot. J. Vietnam. 70, 518-522.
2. Nham NT (1989). Study on Panax vietnamensis Ha et Grushv., Araliaceae: Botany, tissue culture, chemistry, chemistry and biological properties. Herba Polonica. Suppl. II, 24-252.
3. Wen L (2001). Species diversity, nomenclature, phylogeny, biogeography, and classification of the ginseng genus (Panax, Araliaceae). Proceedings of the international ginseng workshop. Nov. 26-29, 2000, Simon Fraser University, Burnaby, B.C., Canada.
4. Komatsu K, Zhu S, Fushimi H, Qui TK, Cai SQ, Kadota S (2001). Phylogenetic analysis based on 18S rRNA gene and matK gene sequences of Panax vietnamensis and five related species. Planta Med. 67, 461-465.
5. Zhu S, Fushimi H, Cai SQ, Chen HB, Komatsu K (2003). A new variety of the genus Panax from Southern Yunnan, China and its nucleotide sequences of 18S ribosomal RNA gene and matK gene. Japanese Botany. 78, 86-94.
6. Nguyen B, Kim KH, Kim YC, Lee SC, Shin JE, Lee JK, Kim NH, Jang WJ, Choi HI, Yang TJ (2017). The complete chloroplast genome sequence of Panax vietnamensis Ha et Grushv (Araliaceae). Mitochondrial DNA A DNA Mapp. Seq. Anal. 28, 85-86.
7. Duc NM, Nham NT, Kasai R, Ito A, Yamasaki K, Tanaka O (1993). Saponins from Vietnamese ginseng, Panax vietnamensis Ha et Grushv, collected in central Vietnam.I. Pharm. Bull. 41, 2010-2014.
8. Duc NM, Kasai R, Ohtani K, Ito A, Nham NT, Yamasaki K, Tanaka O (1994). Saponins from Vietnamese ginseng, Panax vietnamensis Ha et Grushv, collected in central Vietnam.II. Pharm. Bull. 42, 115-122.
9. Duc NM, Kasai R, Ohtani K, Ito A, Nham NT, Yamasaki K, Tanaka O (1994). Saponins from Vietnamese ginseng, Panax vietnamensis Ha et Grushv, collected in central Vietnam.III. Pharm. Bull. 42, 634-6340.
10. Duc NM, Kasai R, Yamasaki K, Nham NT, Tanaka O (1999). New dammarane saponins from Vietnamese ginseng. Plant Sci. 6, 77-82.
11. Tran QL, Adnyana IK, Tezuka Y, Nagaoka T, Tran QK, Kadota S (2001). Triterpene saponins from Vietnamese ginseng (Panax vietnamensis) and their hepatocytoprotective activity. Nat. Prod. 64, 456-461.
12. Yang WZ, Hu Y, Wu WY, Ye M, Guo DA (2014). Saponins in the genus Panax (Araliaceae): A systematic review of their chemical diversity. Phytochemistry. 106, 7-14.
13. Liu J, Xu Y, Yang J, Wang W, Zhang J, Zhang R, Meng Q (2017). Discovery, semisynthesis, biological activities, and metabolism of ocotillol-type saponins. Ginseng Res. 41, 373-378.
14. Le THV, Lee GJ, Vu HKL, Kwon SW, Nguyen MK, Park JH, Nguyen MD (2015). Ginseng saponins in different parts of Panax vietnamensis. Pharm. Bull. 63, 950-954.
15. Le THV, Lee SY, Kim TR, Kim JY, Kwon SW, Nguyen NK, Park JH, Nguyen MD (2014). Processed Vietnamese ginseng. Preliminary results in chemistry and biological activity. Ginseng Res. 38, 154-159.
16. Le THV, Lee GJ, Nguyen NK, Park JH, Nguyen MD (2015). Effect of steaming on saponin compositions and antiproliferative activity of Vietnamese ginseng. Ginseng Res. 39, 274-278.
17. Qi LW, Wang CZ, Yuan CS (2011). Ginsenosides from American ginseng: chemical and pharmacological diversity. Phytochemistry. 72, 689-699.
18. Wang T, Guo R, Zhou G, Zhou X, Kou Z, Sui F, Tang L, Wang Z (2016). Traditional uses, botany, phytochemistry, pharmacology and toxicology of Panax notoginseng (Burk.) F.H.Chen: A review. Journal of Ethnophamacology. 188, 234-258.
19. Tung NH, Quang TH, Ngan NTT, Minh CV, Anh BK, Long PQ, Cuong NM, Kim YH (2011). Oleanolic triterpene saponins from the roots of Panax bipinnatifidus. Pharm. Bull. 59, 1417-1420.
20. Chun L, Yan D, Tung NH, Kim YA, Boo HJ, Cuong NM, Kim YH (2010). Oleanane-type triterpenoids from Panax stipuleanatus and their anticancer activities. Med. Chem. Lett. 20, 7110-7115.
21. Nguyen VB, Park HS, Lee SC, Lee J, Park JY, Yang TJ (2017). Authentication markers for five major Panax species developed via comparative analysis of complete chloroplast genome sequences. Agric. Food Chem. 65, 6298-6306.
22. Trong TT, Truong DH, Nguyen HC, Tran DT, Nguyen Thi HT, Dang GD, Huu HN (2017). Biomass accumulation of Panax vietnamensis in cell suspension cultures varies with addition of plant growth regulators and organic additives. Asian Pac. J. Trop. Med. 10, 907-915
23. Nham NT, De PV, Luan TC, Duc NM, Shibata S, Tanaka O, Kasai R (1995). Pharmacognostical and chemical studies on Vietnamese ginseng, Panax vietnamensis Ha et Grushv. (Araliaceae). Jpn. Bot. 70, 1-10.
24. Dela Pena IJI, Kim HJ, Botanas CJ, Pena JB, Van Le TH, Nguyen MD, Park JH, Cheong JH (2017). The psychopharmacological activities of Vietnamese ginseng in mice: characterization of its psychomotor, sedative-hypnotic, antistress, anxiolytic, and cognitive effects. Ginseng Res. 41, 201-208.
25. To Quyen DH, Minh Truc MT, Thu Huong NT, Minh Duc N (2015). Effect of cultivated Vietnamese ginseng extract on endurance capacity in mice. Journal of medicinal Materials. 20, 181-185.
26. Huong NTT, Matsumoto K, Yamasaki K, Duc NM, Nguyen TN, Watanabe H (1995). Crude saponin extract from Vietnamese ginseng and its major constituent majonoside R2 attenuate the psychological stress- and footshock stress-induced antinociception in mice. Biochem. Behav. 52, 427-432.
27. Huong NTT, Matsumoto K, Yamasaki K, Duc NM, Nham NT, Watanabe H (1996). Effects of majonoside R2 on pentobarbital sleep and gastric lession in psychologically stressed mice. Biochem. Behav. 53, 957-963.
28. Huong NTT, Matsumoto K, Watanabe H (1998). The antistress effect of majonoside R2, a major saponin component of Vietnamese ginseng: neuronal mechanism of action. Methods Find. Exp. Clin. Pharmacol. 20, 65-76.
29. Huong NTT, Matsumoto K, Yamasaki K, Duc NM, Nham NT, Watanabe H (1996). Effects of Vietnamese ginseng on opioid agonist and conditioned fear stress-induced antinociception. Phytomedicine. 3, 33-39.
30. Huong NTT, Matsumoto K, Yamasaki K, Duc NM, Watanabe H (1996). The possible involvement of GABAA systems in the antinarcotic effect of majonoside R2, a major constituent of Vietnamese ginseng. Jpn. J. Pharmacol. 71, 345-349.
31. Huong NTT, Matsumoto K, Yamasaki K, Duc NM, Watanabe H (1997). Majonoside R2, a major constituent of Vietnamese ginseng, attenuates opioid-induced antinociception. Biochem. Behav. 57, 285-291.
32. Huong NTT, Matsumoto K, Yamasaki K, Watanabe H (1997). The reversing effect of majonoside R2 on social isolation-induced decrease in pentobarbital sleep: Neuro-steroidal involvement. Life Sci. 6, 395-402.
33. Huong NTT, Murakami Y, Tohda M, Watanabe H, Matsumoto K (2005). Social isolation stress-induced oxidative stress damage in mouse brain and its modulation by majonoside R2, a Vietnamese ginseng saponin. Pharm. Bull. 28, 1389-1393.
34. Konoshima T, Takahashi M, Tokuda H, Nishino H, Duc NM, Kasai R, Yamasaki K (1998). Anti-tumor-promoting activity of majonoside R2 from Vietnamese ginseng, Panax vietnamensis Ha et (I). Biol. Pharm. Bull. 21, 834-838.
35. Mizutani K (1994). Biological activities, production, and use of chemical constituents of licorice in food phytochemicals for cancer prevention II. In: Ho CT, Osawa T, Huang MT, Rosen RT, editors. Teas, Spices and Herbs. Washington DC: American Chemical Society. 322-328.
36. Konoshima T, Takasaki M, Ichiishi E, Murakami T, Tokuda H, Nishino H, Duc NM, Kasai R, Yamasaki K (1999). Cancer chemopreventive activity of majonoside R2 from Vietnamese ginseng, Panax vietnamensis. Cancer Lett. 147, 11-16.
37. Nguyen TD, Villard PH, Barlatier A, Elsisi AE, Jouve E, Duc NM, Sauze C, Durand A, Lacarelle B (2002). Panax vietnamensis protects mice against carbon tetrachloride-induced hepatotoxicity without any modification of CYP2E1 gene expression. Planta Med. 68, 402-406.
38. Tran LQ, Adnyana IK, Tezuka Y, Harimaya Y, Kurashige Y, Saiki I, Tran KQ, Kadota S (2002). Hepatoprotective effect of majonoside R2, the major saponin from Vietnamese ginseng (Panax vietnamensis). Planta Med. 68, 402-406.
39. Dương Hồng Tố Quyên, Nguyễn Thị Thu Hương, Lê Huỳnh Thi, Nguyễn Minh Đức (2015). Nghiên cứu tác dụng giải lo âu và chống trầm cảm của cao chiết từ Sâm Việt Nam trồng trên chuột bị stress cô lập. Tạp chí Dược liệu. 20, 378-383.
40. Dương Tấn Nhựt, Hoàng Thanh Tùng, Trịnh Thị Hương, Nguyễn Hồng Hoàng, Vũ Thị Hiền, Nguyễn Bá Nam, Nguyễn Phúc Huy, Vũ Quốc Luận, Phạm Bích Ngọc, Chu Hoàng Hà, Trần Thị Thùy An, Trần Đình Phương, Nguyễn Thị Thu Hương, Trần Công Luận (2015). Đánh giá tác dụng tăng lực của saponin trong rễ tơ chuyển gen Sâm Ngọc Linh. Tạp chí Công nghệ sinh học. 13, 75-82.
41. Kim OT, Le MD, Trinh HX, Nong HV (2016). In silico studies for the interaction of tumor necrosis factor-alpha (TNF-α) with different saponins from Vietnamese ginseng (Panax vietnamensis) (2016). Physicobiol. 13, 173-180.
42. Nguyễn Thị Thu Hương, Chung Thị Mỹ Duyên, Dương Hồng Tố Quyên, Nguyễn Minh Đức (2016). Khảo sát tác dụng của cao Sâm Việt Nam trồng trên một số chức năng miễn dịch ở động vật bị gây stress cô lập. Tạp chí Dược liệu. 21, 60-65.
43. Nguyễn Thị Thu Hương, Mai Thành Chung (2016). Khảo sát tác dụng của sâm Việt Nam trồng trên mô hình gây hen bằng ovalbumin ở chuột nhắt trắng Swiss albino. Tạp chí Dược liệu. 21, 407-411.
44. To Quyen DH, Phuong TN, Thu Huong NT, Duc NM (2016). Effects of ocotillol-type saponins majonoside-R1 and vina-ginsenoside-R2 on abrogating depression and neuronal oxidative stress in socially isolated depression mouse model, International Journal of Applied Research in Natural Products. 9, 27-32.
45. Nguyễn Hoàng Minh, Nguyễn Thị Thu Hương, Dương Hồng Tố Quyên, Nguyễn Minh Đức (2017). Khảo sát tác dụng của bột chiết sâm Việt Nam trồng trên tổn thương oxy hóa tế bào não gây bởi stress cô lập. Tạp chí Dược liệu. 22, 93-98.
46. Dương Hồng Tố Quyên, Nguyễn Thị Thu Hương, Nguyễn Minh Đức (2017). Khảo sát tác dụng của các bột chiết từ sâm Việt Nam trồng trên sự rút ngắn giấc ngủ pentobarbital gây bởi stress cô lập. Tạp chí Dược liệu. 22, 109-113.
47. Dương Hồng Tố Quyên, Nguyễn Thị Thu Hương, Vũ Huỳnh Kim Long, Nguyễn Minh Đức (2015). Nghiên cứu hoạt tính chống oxy hóa in vitro của saponin toàn phần từ Sâm Việt Nam trồng (Panax vietnamensis Ha et Grushv.). Y học TP. Hồ Chí Minh, 19, 157-164.
48. Nguyen Thi Thu Huong, Pham Thi Nguyet Hang, Taro Yamaguchi, Masanori Yoneyama, Kyokazu Ogita (2017). The effects of cultivated Vietnamese ginseng extract on trimethyltin-induced neuronal loss in the mouse dentate gyrus. Journal of Medicinal Materials. 22, 155-162.
49. Danh My Thanh Ngan, Nguyen Minh Duc, Nguyen Ngoc Khoi (2017). Protective Effect of Processed Vietnamese Ginseng against Paracetamol-Induced Hepatotoxicity in Mice. Journal of Medicinal Materials. 22, 166-172.
50. Duong Hong To Quyen, Nguyen Thi Thu Huong, Nguyen Thuy Viet Phuong, Nguyen Minh Duc (2017). Hepatoprotective activity of cultivated Vietnamese ginseng extract on oxidative stress-induced liver injury in mice. Journal of Medicinal Materials. 22, 183-189.
51. Dương Hồng Tố Quyên, Nguyễn Thị Thu Hương, Nguyễn Minh Đức (2015). Nghiên cứu tác dụng bảo vệ gan của saponin toàn phần từ Sâm Việt Nam trồng trên thực nghiệm gây tổn thương gan bằng carbon tetraclorid trên chuột nhắt trắng. Y học TP. Hồ Chí Minh. 19, 143-148.
52. Mai Thành Chung, Trần Mỹ Tiên, Nguyễn Thị Thu Hương, Dương Thị Mộng Ngọc, Trần Công Luận, Trần Hảo (2015). Khảo sát tác dụng tăng lực và tác dụng kiểu nội tiết tố sinh dục nam của cao chiết phối hợp Sâm Việt Nam và Bách bệnh. Y học TP. Hồ Chí Minh. 19, 149-156.
PGS.TS Phương Thiện Thương (Phó Viện trưởng Viện VKIST)





