ThS. Nguyễn Thị Thanh Huyền
Phòng Công nghệ Tích hợp - VKIST
Theo thống kê của GLOBOCAN, năm 2022 tại Việt Nam sẽ có 180.480 ca mắc mới và 120.184 ca tử vong do ung thư. Đáng chú ý hơn, số người mắc bệnh ung thư ở Việt Nam đã tăng gấp ba lần sau 30 năm và số ca mắc mới có xu hướng ngày càng trẻ hơn. Tỷ lệ tử vong do ung thư ở Việt Nam đang ở mức báo động 73,5%, trong khi tỷ lệ của thế giới chỉ là 59,7%. Thống kê cũng cho thấy có 5 loại ung thư được chẩn đoán thường xuyên nhất với tỷ lệ được tính cho cả hai giới và mọi lứa tuổi: ung thư vú 13,6%, ung thư gan 13,6%, ung thư phổi 13,5%, ung thư phổi 13,5%. ung thư đại trực tràng 9,3% và ung thư dạ dày 9,0%. Như vậy, có thể thấy cả số ca mắc mới và số ca tử vong do ung thư ở Việt Nam đều tăng nhanh. Tình trạng này cũng tương tự như nhiều nước trên thế giới, trong đó có các nước phát triển như Anh, Pháp, Ý, Nhật Bản, Hàn Quốc, Thái Lan, Mỹ. Tuy nhiên, tỷ lệ tử vong do ung thư ở các nước này đã giảm.
Tỷ lệ tử vong do ung thư sẽ giảm khi các trường hợp được phát hiện và điều trị sớm. Có hai thành phần của việc phát hiện sớm đó là chẩn đoán sớm và sàng lọc.
Trong bài viết này, chúng tôi sẽ giới thiệu ngắn gọn về nguyên lý hoạt động của que thử sắc ký miễn dịch dòng chảy bên và một vài kết quả nổi bật trong chiến lược phát triển que thử ứng dụng theo dõi tái phát và điều trị hiệu quả ung thư vú và ung thư đại tràng tại Viện VKIST.
Que thử sắc ký miễn dịch dòng chảy bên (Lateral Flow ImmunoAssay-LFIA) là gì?
Xét nghiệm sắc ký miễn dịch dòng bên (LFIA) là thiết bị chẩn đoán dùng một lần, dễ sử dụng, có thể kiểm tra các dấu ấn sinh học trong các mẫu như nước bọt, máu, nước tiểu và thực phẩm. Những xét nghiệm này có một số ưu điểm so với các công nghệ chẩn đoán khác bao gồm tính đơn giản, chi phí thấp và tính chất mạnh mẽ. Thử nghiệm dòng chảy ngang tiêu chuẩn tạo ra tín hiệu quang học phát sinh từ các hạt có màu sắc mạnh liên kết với các vạch thử nghiệm trên dải nitrocellulose màu trắng. Tín hiệu này có thể được đọc bằng mắt (định tính) hoặc bằng dụng cụ (định lượng). Để tối đa hóa độ nhạy của thiết bị, mỗi sự kiện liên kết phải tạo ra tín hiệu mạnh nhất có thể. Sự liên kết mạnh mẽ và hiệu quả của kháng thể với bề mặt của hạt báo cáo là rất quan trọng để đạt được độ nhạy và độ chọn lọc mục tiêu của xét nghiệm. Hấp phụ thụ động là phương pháp truyền thống để gắn kháng thể vào đầu dò hạt nano dòng chảy bên và vẫn được sử dụng rộng rãi do chuẩn bị liên hợp nhanh chóng và dễ dàng. Đối với kháng thể có sẵn các amin tự do để liên kết, liên hợp cộng hóa trị có thể được sử dụng để đảm bảo protein gắn kết lâu dài, bền vững với bề mặt hạt nano. Các liên hợp cộng hóa trị thường mang lại độ ổn định cao hơn trong các ma trận mẫu đầy thách thức, trong một loạt các điều kiện pH và ở nồng độ chất hoạt động bề mặt hoặc chất tẩy rửa cao.
Nguyên lý hoạt động của LFIA
Que thử sắc ký miễn dịch chỉ thị màu bao gồm các bộ phận cơ bản như được trình bày trên hình 1.
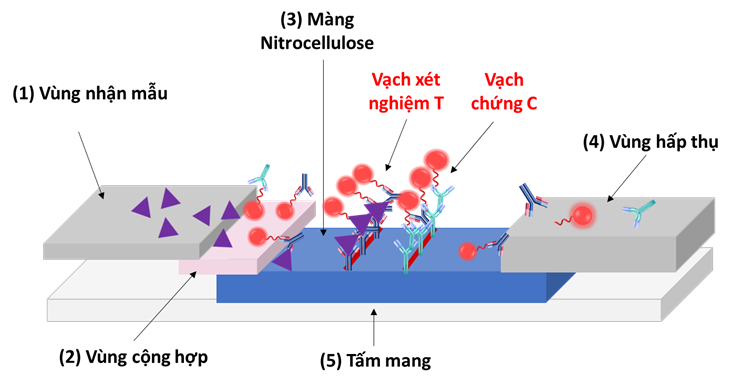
Hình 1: Cấu trúc nguyên lý của que thử sắc kí miễn dịch dòng chảy bên LFIA.
Các thành phần của que thử bao gồm: (1) Vùng nhận mẫu hoạt động như một miếng đệm hút mẫu và vận chuyển mẫu tới vùng cộng hợp; (2) Vùng cộng hợp chứa liên hợp kháng thể-hạt nano đã khô; (3) Vùng phát hiện sử dụng màng nitrocellulose có chứa “vạch thử (test line)” và “vạch chứng (control line)” thể hiện kết quả xét nghiệm. Màng nitrocellulose cố định kháng thể để bắt giữ lại chất thử “kháng nguyên”, có đặc tính không ngăn cản chất lỏng chảy theo hướng nằm ngang và là màng mỏng xốp có hoạt động mao dẫn; (4) Vùng hấp thụ sử dụng vật liệu có khả năng hấp thụ nước cao để hấp thụ các thành phần được và không được cung cấp cho phản ứng ở vùng phát hiện; (5) Tấm mang (packing card) là bộ phận để lắp và cố định tất cả các thành phần nêu trên tức là bao gồm vùng hút mẫu, vùng cộng hợp, vùng phát hiện và vùng hấp thụ.
Nguyên lý hoạt động chung của que thử nhanh là mẫu chất lỏng chứa kháng nguyên đích được đưa vào từ vùng nhận mẫu sẽ bắt đầu di chuyển theo dòng. Khi đến vùng cộng hợp, kháng nguyên đích sẽ được liên kết/gắn vào phức hợp hạt-kháng thể đã được trải sẵn và tiếp tục di chuyển đến vùng của hai dải thử nghiệm và dải đối chứng nhờ các mao dẫn. Tại đậy, dải thử nghiệm chứa kháng thể đơn dòng sẽ bị bắt giữ lại những hạt có mang kháng nguyên đích và màu sẽ bắt đầu xuất hiện tại vạch này nhờ các hạt màu. Còn những hạt không mang kháng nguyên đích sẽ tiếp tục đi đến vùng đối chứng có trải sẵn kháng thể IgG. Kháng thể này có vai trò bắt giữ toàn bộ các kháng thể sơ cấp chứa trong vùng cộng hợp, không phân biệt kháng thể tự do hay cộng hợp với kháng nguyên. Cho nên việc thu tín hiệu từ vùng này nhằm mục đích kiểm tra quy trình thao tác xét nghiệm, khẳng định lượng dung dịch mẫu đã đủ và màng thấm tốt. Do đó, sự xuất hiện màu ở vùng này khẳng định hiệu lực của kết quả xét nghiệm. Trên hình 2 trình bày kết quả xét nghiệm thông qua sự hiện diện màu sắc trên vạch thử nghiệm và vạch đối chứng của que thử LFIA cấu trúc “sandwich”.
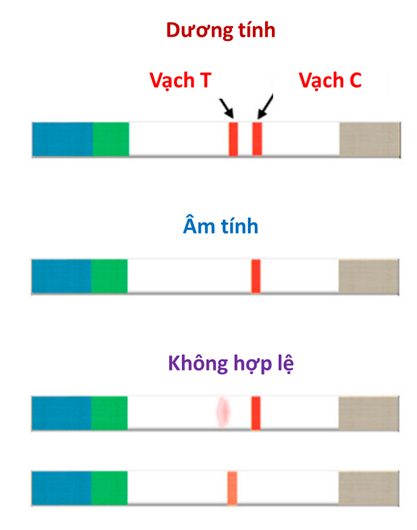
Hình 2: Hình ảnh kết quả xét nghiệm thông qua sự hiện diện màu sắc trên vạch thử nghiệm và vạch đối chứng của que thử LFIA cấu trúc “sandwich”.
Sự khác biệt của LFIA do VKIST phát triển so với LFIA truyền thống
Hiện tại, đã có một số bộ xét nghiệm đã được phát triển và lưu hành sử dụng que thử sắc ký miễn dịch cho phép phát hiện nhanh và định tính chất chỉ điểm ung thư (cancer marker) có trong huyết thanh hoặc huyết tương người và rất ít thực hiện được trên mẫu máu toàn phần. Thêm nữa, các bộ xét nghiệm này hầu hết sử dụng kỹ thuật hấp phụ thụ động (passive conjugation) để gắn kháng thể vào hạt nano vàng trần (bare gold nanoparticle). Bằng cách tận dụng lực liên phân tử giữa các phân tử và bề mặt, ví dụ như lực van der Waals và lực ion, các kháng thể sẽ tự liên kết với bề mặt hạt nano vàng trần để tạo thành liên hợp, các hạt nano vàng có màu sắc để tạo ra nhãn màu hay màu sắc biểu thị kết quả của xét nghiệm. Các liên kết van der Waals hoặc lực ion được cho là các liên kết yếu, có thể dẫn đến suy giảm tính nguyên vẹn của liên hợp và có khả năng các kháng thể sẽ bị tách ra khỏi bề mặt hạt trong một số điều kiện nhất định như có sự thay đổi về nồng độ muối hoặc pH của dung dịch dẫn tới làm giảm độ đặc hiệu của xét nghiệm. Nói cách khác, xét nghiệm dễ xảy ra hiện tượng dương tính giả hoặc âm tính giả. Hơn nữa, trong quá trình liên hợp thụ động, sự định hướng của kháng thể trên bề mặt hạt nano không được kiểm soát tốt do cách thức mà kháng thể và các hạt được trộn lẫn với nhau một cách đơn giản dẫn tới làm giảm độ nhạy của xét nghiệm.
Tại VKIST, chúng tôi đã phát triển công nghệ chế tạo que thử sắc ký miễn dịch dòng chảy bên sử dụng hạt liên hợp cộng hóa trị phát hiện chất chỉ điểm ung thư trong mẫu máu toàn phần. Theo công nghệ này, hạt liên hợp (conjugate particles), cốt lõi của xét nghiệm sắc ký miễn dịch dòng chảy bên, còn được gọi là hạt nano báo cáo (reporter nanoparticles), có màu sắc rõ ràng bao gồm hạt nano vàng dạng cầu đặc (màu đỏ) và hạt nano vàng dạng cầu rỗng (màu xanh). Các kháng thể nhận biết kháng nguyên mục tiêu được liên kết cộng hóa trị với bề mặt hạt nano vàng tạo thành hạt liên hợp cộng hóa trị (covalent conjugation). Hạt liên hợp được tạo thành này có một số ưu điểm so với hạt liên hợp thụ động (passive conjugation) truyền thống như sau:
- Liên hợp cộng hóa trị mang lại độ ổn định cao hơn, giúp giải quyết các hạn chế liên quan đến mẫu phải sử dụng đệm ở điều kiện khắc nghiệt như có muối hoặc chất có tính chất tẩy rửa cao.
- Cần ít kháng thể hơn để tối đa hóa độ nhạy, dẫn tới giảm tổng chi phí của xét nghiệm.
- Các hạt liên hợp được chuẩn bị dễ dàng và nhất quán mà không cần phải sàng lọc nồng độ muối và chuẩn độ pH trên diện rộng, giúp tiết kiệm thời gian khi thực hiện các thí nghiệm sàng lọc kháng thể.
- Tỷ lệ kháng thể trên hạt có thể được kiểm soát chính xác, điều này rất quan trọng để điều chỉnh phạm vi động trong các xét nghiệm cạnh tranh và tối ưu hóa độ nhạy khi sử dụng kháng thể có động học liên kết khác nhau.
Hơn nữa, chúng tôi đã sử dụng màng tách máu tại vùng nhận mẫu. Khoảng 20 mL máu toàn phần trích từ đầu ngón tay được nhỏ trực tiếp lên vùng nhận mẫu, sau đó nhỏ tiếp dung dịch đệm được cấp cùng với bộ xét nghiệm để đưa huyết tương đi qua miếng đệm mẫu và màng để hoàn thành xét nghiệm. Trong thực tế, huyết tương thường cần được tách khỏi máu toàn phần để đảm bảo độ nhạy và độ chọn lọc trong phép đo, vì tế bào trong máu toàn phần là thành phần phức tạp và không ổn định. Ngoài ra, màu đỏ tự nhiên của huyết sắc tố trong máu toàn phần cản trở việc đọc tín hiệu quang học trên que thử. Do đó, cần phải nhanh chóng tách tế bào máu khỏi máu toàn phần để chẩn đoán chính xác. Quy trình truyền thống được các phòng thí nghiệm sử dụng để tách huyết tương là ly tâm, dựa vào thiết bị lớn và cần phải có lượng mẫu máu đáng kể. Việc sử dụng màng tách máu tại vùng nhận mẫu của que thử theo đề xuất của sáng chế mang lại những lợi ích sau:
- Loại bỏ nhu cầu lưu trữ, ly tâm hoặc đông mẫu máu.
- Không yêu cầu chuyên môn kỹ thuật và thiết bị phòng thí nghiệm.
- Sử dụng tại chỗ.
- Kết quả xét nghiệm có độ tin cậy cao.
Một số hình ảnh và video giới thiệu sản phẩm que thử LFIA do VKIST phát triển
Với những lợi ích và ưu điểm tuyệt vời của que thử sắc ký miễn dịch dòng chảy bên trong việc theo dõi khả năng tái phát của các chỉ dấu ung thư thì hiện nay tại phòng Công nghệ tích hợp thuộc VKIST, chúng tôi đang có các dự án về chế tạo que thử sắc ký miễn dịch phát hiện vi rút lây nhiễm, vi khuẩn gây nhiễm trùng bệnh viện và vi rút cúm gia cầm.
Dưới đây là hình ảnh các sản phẩm que thử sắc ký miễn dịch theo dõi khả năng tái phát của các bệnh ung thư phổ biến như ung thư vú (chỉ dấu ung thư CA15-3) và ung thư đại trực tràng (chỉ dấu ung thư CEA) và sản phẩm que thử nhanh phát hiện các loại vi rút viêm gan B, vi rút cúm gia cầm H5N1 và vi khuẩn E.coli, Klebsiella, Pseudomonas aeruginosa.
Que thử phát hiện chỉ dấu ung thư vú và đại tràng đã được khảo nghiệm lâm sàng trên 40 mẫu máu bệnh nhân mắc ung thư và gần 200 mẫu máu bệnh nhân khỏe cho kết quả về độ nhạy lớn hơn 98% và độ đặc hiệu, độ tin cậy lớn hơn 99,6%. Đối với que thử kháng nguyên bề mặt của vi rút viêm gan B, độ đặc hiệu, độ nhạy và độ tin cậy đều lớn hơn 99,5% với số lượng mẫu khảo nghiệm lâm sàng là 59 mẫu dương tính và 165 mẫu âm tính. Ba loại que thử này đều đã được gửi hồ sơ xin cấp bằng bảo hộ sáng chế trong năm 2023 và 2024.
Dưới đây là một số hình ảnh của sản phẩm que thử nhanh và một số hoạt động chuyên môn liên quan đến sản phẩm.

Hình ảnh một số sản phẩm que thử nhanh được VKIST chế tạo.

Hình ảnh gian hàng triển lãm sản phẩm que thử tại Hội nghị triển khai Kế hoạch tổ chức sự kiện Kết nối công nghệ và Đổi mới sáng tạo Việt Nam năm 2023 - Techconnect and Innovation Vietnam 2023.

Nhóm nghiên cứu VKIST thực hiện xét nghiệm máu phát hiện chỉ dấu ung thư đại tràng và ung thư vú cho người dân ở Vĩnh Yên, Vĩnh Phúc.

Nhóm nghiên cứu tham dự sự kiện Pitch talk tại chương trình Cầu nối giữa chính phủ Canada và doanh nghiệp Việt Nam.

Hình ảnh giới thiệu sản phẩm cho các quan khách, đơn vị và cơ quan nghiên cứu tới tham quan Viện VKIST.
Video giới thiệu cách sử dụng que thử phát hiện chỉ dấu ung thư đại tràng CEA.
Tài liệu tham khảo
1. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics (2018) GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA a Cancer J Clin. 2018;68(6):394–424. doi:10.3322/caac.21492.
2. Shinya Tsuda, Mitsuro Kameya-Iwaki, Kaoru Hanada, Yoshiko Kouda, Mikio Hikata, Keiichi Tomaru (1991) A Novel Detection and Identification Technique for Plant Viruses: Rapid Immunofilter Paper Assay (RIPA) X. Plant Dis. 76:466-469. DOI: 10.1094/PD-76-0466.
3. Gussenhoven GC, van der Hoorn MA, Goris MG, Terpstra WJ, Hartskeerl RA, Mol BW, van Ingen CW, Smits HL. LEPTO dipstick, (1997) A dipstick assay for detection of Leptospira-specific immunoglobulin M antibodies in human sera. J Clin Microbiol. 1997 Jan;35(1):92-7. doi: 10.1128/jcm.35.1.92-97.1997. PMID: 8968886; PMCID: PMC229517.
4. Lonnberg, M.a.J.C., (2001), Quantitative detection in the attomole range for immunochromatographic tests by means of a flatbed scanner, Analytical Biochemistry 293, pp.224-231.
5. Oberdorster, G., Maynard, A., Donaldson, K., Castranova, V., Fitz- Patrick, J., Ausman, K., Carter, J., Karn, (2005), Part Fibre Toxicol 2, pp.8-43.





