Ngược lại với kháng thể protein, Aptamer có các đặc tính hóa học và sinh học độc đáo dựa trên đặc tính oligonucleotide của chúng. Trọng tâm của bài viết này là đưa ra các thông tin cơ bản về Aptamer và giới thiệu về tiềm năng ứng dụng của chúng trong việc thay thế cho kháng thể “protein” trong việc nhận biết virus mục tiêu.
APTAMER
Thuật ngữ “Aptamer” và “SELEX” được hai nhóm nghiên cứu độc lập giới thiệu vào năm 1990. Thuật ngữ “Aptamer” dùng để chỉ các phối tử axit nucleic nhỏ thể hiện chức năng điều trị cụ thể và ái lực gắn kết rõ ràng với đích của chúng. Ngược lại, sự tiến hóa có hệ thống của các phối tử bằng công nghệ làm giàu hàm mũ (SELEX) là phương pháp được sử dụng để phát triển Aptamer.
Aptamer là các chuỗi nucleic acid sợi đơn, ngắn, được giới thiệu lần đầu tiên vào năm 1990 (Ellington và Szostak 1990, Tuerk và Gold 1990), nó có khả năng liên kết với nhiều mục tiêu như kim loại, hợp chất hóa học, protein và tế bào. Ý tưởng về việc các nucleic acid này có khả năng hoạt động như các phối tử và có khả năng điều khiển hoạt động của protein mục tiêu là kết quả của nghiên cứu thực hiện trên virus HIV (Virus gây hội chứng suy giảm miễn dịch ở người), những virus này được mã hóa bởi các RNA nhỏ, có cấu trúc liên kết được với protein nội bào tạo điều kiện thuận lợi cho sự nhân lên của virus hoặc làm giảm hoạt động chống virus của vật chủ. Năm 1990, Sullenger và cộng sự đã công bố nghiên cứu chứng minh rằng Aptamer RNA được thiết kế để liên kết với protein của virus đã giúp ngăn chặn sự nhân lên của RNA virus. Trên hình 1 trình bày sơ đồ khối mô tả sự hình thành cấu trúc 3D từ sợi đơn Aptamer và sự hình thành liên kết của cấu trúc 3D này với mục tiêu.
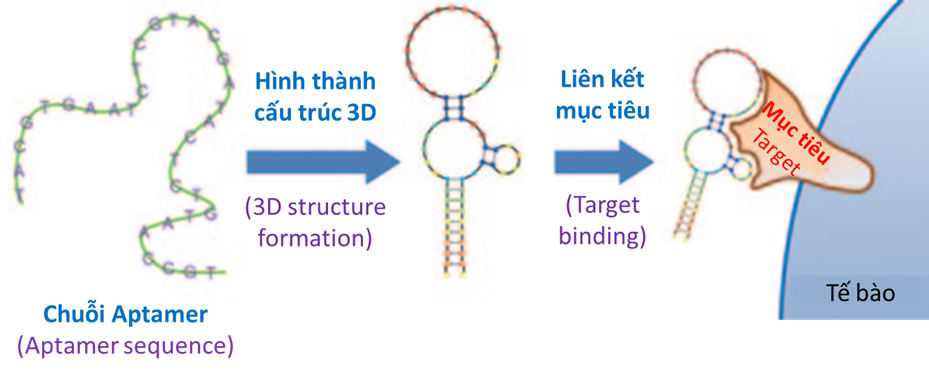
Hình 1: Sơ đồ khối mô tả sự hình thành cấu trúc 3D từ sợi đơn Aptamer và sự hình thành liên kết của cấu trúc 3D này với mục tiêu.
Cùng là các phối tử sinh học, tuy nhiên do có kích thước gọn nhẹ nên Aptamer thể hiện nhiều ưu điểm vượt trội so với kháng thể “protein” như thời hạn sử dụng lâu dài, sự sai khác trong quá trình sản xuất thường ít xảy ra, ít hoặc gần như không gây ra đáp ứng miễn dịch cho cơ thể (phản ứng phụ), linh hoạt để kết hợp với các hợp chất đã được sửa đổi để tăng cường sự ổn định và ái lực nhắm vào mục tiêu. Do đó, Aptamer đã nhanh chóng định hướng được con đường của nó trong các ứng dụng đa dạng từ trị liệu, phân phối thuốc, chẩn đoán và hoạt động như một gene chức năng cho đến việc tham gia vào cảm biến sinh học.
Aptamer thường được phát triển in vitro bởi một chu trình sản xuất bao gồm các vòng lặp được gọi là SELEX (Systematic Evolution of Ligands by Expotential enrichment). Trên hình 2 mô tả các bước cơ bản trong quy trình SELEX. Quy trình SELEX ban đầu được đưa ra tiêu tốn nhiều thời gian và công sức. Tuy nhiên, trong hơn 3 thập kỉ qua, bằng cách điều chỉnh và tích hợp các tiến bộ trong khoa học vật liệu và các kĩ thuật phân tích, nhiều phiên bản của SELEX đã được phát triển nhằm nỗ lực giảm thời gian hoàn thành. Sự tiến bộ trong các quy trình chọn lọc Aptamer góp phần đáng kể vào việc thương mại hóa và ứng dụng lâm sàng của chúng. Tuy nhiên, số lượng Aptamer thể hiện được khả năng liên kết với mục tiêu mạnh và đặc hiệu còn có một số điểm hạn chế. Do vậy, các nhà nghiên cứu vẫn đang nỗ lực đưa ra các giải pháp khoa học tối ưu khắc phục các điểm hạn chế này.
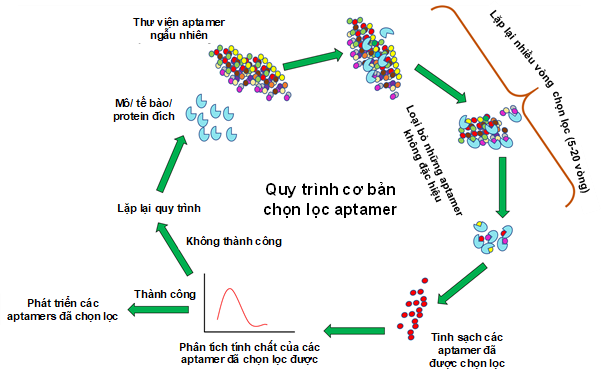
Hình 2: Các bước trong quy trình SELEX chọn lọc aptamer trong ống nghiệm.
ỨNG DỤNG CỦA APTAMER TRONG PHÁT HIỆN VIRUS
Virus là tác nhân gây nhiễm trùng có khả năng tự sao chép hệ gene của nó bên trong tế bào vật chủ. Chẩn đoán sớm và chính xác virus đóng vai trò rất quan trọng trong việc kiểm soát lâm sàng và điều trị cho bệnh nhân nhiễm virus. Hiện nay, các xét nghiệm thường được sử dụng để chẩn đoán sớm và hiệu quả các bệnh do virus gây ra chủ yếu dựa trên phương pháp PCR hoặc phương pháp phát hiện kháng nguyên/ kháng thể của virus. Nhu cầu về các xét nghiệm chẩn đoán nhanh, hiệu quả và thao tác dễ dàng đang ngày càng cấp thiết trong việc đối phó với sự biến đổi nhanh chóng và mạnh mẽ của các chủng loại virus Aptamer với ái lực và độ đặc hiệu tương tự kháng thể đang dần được sử dụng như một giải pháp thay thế mới.
Các kĩ thuật hiện tại thường được sử dụng để chẩn đoán bệnh nhiễm trùng do virus gây ra bao gồm: phân lập virus trong nuôi cấy mô, phương pháp miễn dịch và sinh học phân tử. Tuy nhiên, các phương pháp kể trên có một số hạn chế như đòi hỏi kĩ thuật cao, chi phí cần sử dụng lớn, có thể xảy ra kết quả chẩn đoán dương tính giả hoặc âm tính giả, trong khi đó phương pháp xét nghiệm virus bằng Aptamer có thể giúp cải thiện một phần những nhược điểm này.
Cảm biến sinh học là một thiết bị phân tích kết hợp giữa một thụ thể sinh học và bộ chuyển đổi tín hiệu. Thụ thể sinh học nhận biết và liên kết đối tượng đích với độ nhạy và độ đặc hiệu cao, đồng thời có thể ngăn chặn sự can thiệp từ các vi sinh vật và các phân tử khác. Sau đó bộ chuyển đổi giúp đọc và đưa ra các tín hiệu sinh học dựa trên tương tác giữa chất cần phân tích và thụ thể sinh học. Cảm biến sinh học dựa trên Aptamer được gọi là Aptasensor, là phương pháp dùng Aptamer như một đầu dò bắt giữ (thụ thể sinh học) hoặc một bộ phát tín hiệu (đầu dò tín hiệu).
Aptasensor dựa trên SPR
Cộng hưởng plasmon bề mặt (SPR) có thể theo dõi các tương tác phân tử trong thời gian thực và là một kỹ thuật cảm biến sinh học và hóa học được phát triển mạnh mẽ cũng như được sử dụng rộng rãi. Trong số các ứng dụng cảm biến dựa trên SPR khác nhau, cảm biến sinh học SPR dựa trên Aptamer đã thu hút được sự chú ý đáng kể vì tính đơn giản, tính khả thi và chi phí phát hiện mục tiêu thấp.
Cơ chế của cảm biến aptasensor SPR tương tự như cơ chế của các cảm biến khác: Aptamer được cố định trên bề mặt cảm biến, sau đó đầu dò Aptamer nhận dạng và tương tác với mục tiêu của nó; ở bước cuối cùng, bộ chuyển đổi quang học chuyển đổi thông tin tương tác này thành tín hiệu có thể phát hiện được. Phương pháp phát hiện trực tiếp này nhanh hơn nhiều so với các chế độ cảm biến SPR khác vì cần ít bước hơn và ít thời gian hơn. Đáng chú ý là hầu hết các phân tử nhỏ chỉ liên kết với Aptamer bằng cấu hình liên kết một vị trí vì không có chỗ cho Aptamer tương tác với phân tử thứ hai. Trên hình 3 trình bày sơ đồ nguyên lý của một Aptasensor SPR phát hiện virus. Aptamer bắt giữ được cố định trên bề mặt điện cực kim loại (thường là vàng), sự liên kết giữa virus và Aptamer trên bề mặt điện cực sẽ làm thay đổi độ dày của nó, từ đó làm cho chiết suất thay đổi. Dựa vào sự thay đổi này để xác định lượng virus có trong mẫu.
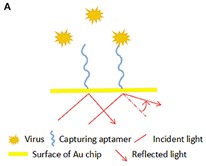
Hình 3: Cơ chế của Aptasensor SRP dựa trên tương tác của virus và Aptamer làm thay đổi góc phản xạ, từ đó cho biết lượng virus bị các Aptamer bắt giữ.
Năm 2012, Bai và cộng sự đã chọn lọc thành công Aptamer phát hiện virus cúm gia cầm (AIV) H5N1 trong vòng 1,5 giờ với độ nhạy từ 0,128 đến 1,280 đơn vị hồng cầu (HAU). So với các phương pháp khác, Aptasensor là một phương pháp nhanh và có tính di động. Tuy nhiên, độ nhạy của chúng thấp hơn so với phương pháp phân lập virus và PCR. Trong một nghiên cứu khác của Nguyen và cộng sự (2016), cặp Aptamer IF10 và IF22 cũng lần lượt được xác định vai trò là đầu dò bắt giữ và đầu dò tín hiệu cho virus H5N1 ở các vị trí liên kết khác nhau. Những nghiên cứu này đã tạo dựng được một nền tảng cảm biến sinh học SPR để phát hiện virus H5N1.
Aptamer liên kết với enzyme (ELAA)
ELISA là phương pháp xét nghiệm cơ bản để phát hiện các phân tử đích có cấu trúc phức tạp. ELAA, Aptamer được sử dụng để thay thế các kháng thể sinh học thông thường để làm thụ thể sinh học hoặc chất phát tín hiệu. ELAA còn được gọi là xét nghiệm hấp phụ oligonucleotide liên kết với ezyme (ELOSA hoặc ELONA) hoặc xét nghiệm Aptasobent liên kết với enzyme (ELASA).
Năm 2014, Shiratori và cộng sự đã sử dụng Aptamer RHA0006 trong ELAA để phát hiện virus cúm A H5N1. Aptamer này có liên kết đặc hiệu với protein hemagglutinin (HA). Trong aptasensor này, Aptamer được cố định trên giếng để bắt giữ protein HA và một aptamer 3’-biotinylated khác tạo ra phản ứng màu với streptavidin (SA)-hourseadish peroxidase (xem hình 4). Các nghiên cứu tương tự cũng đã được phát triển và cho thấy việc sử dụng Aptamer để phát hiện thay thế cho kháng thể sinh học đưa lại hiệu quả tương đương với phương pháp ELISA.
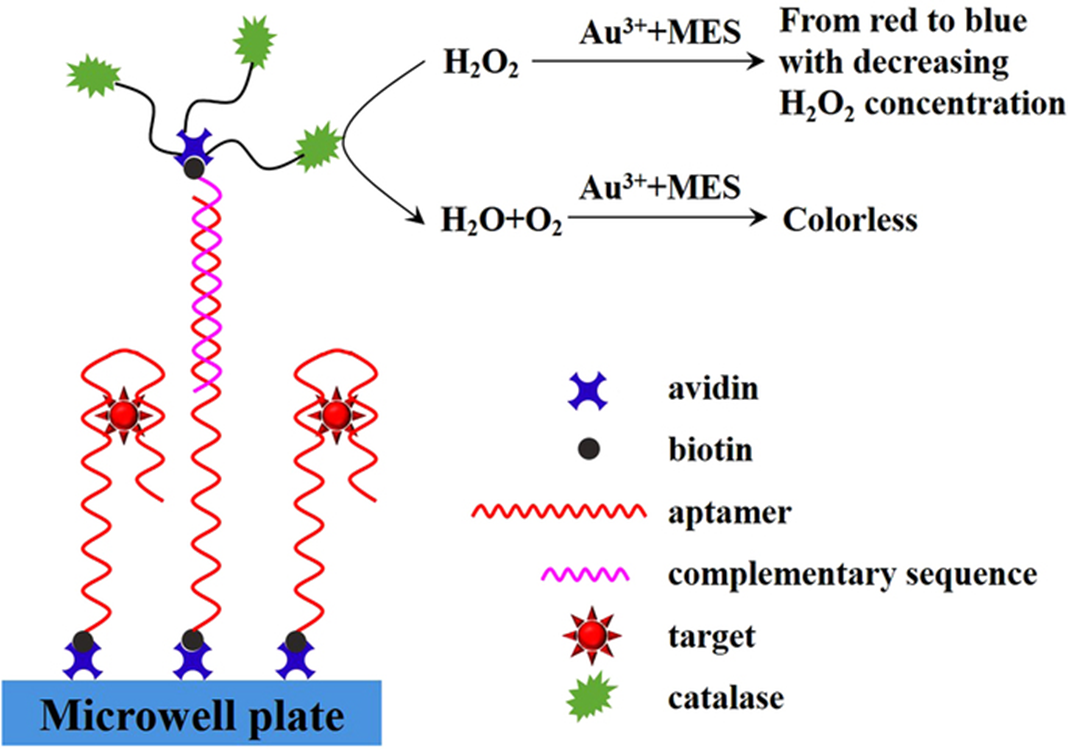
Hình 4: Sơ đồ minh họa của phương pháp ELAA.
ỨNG DỤNG KHÁC CỦA APTAMER
Aptamer trong y học tái tạo
Ngày 21 tháng 9 năm 2023, một nhóm các nhà nghiên cứu đến từ Đại học Shinshu, Viện Khoa học và Công nghệ Công nghiệp Tiên tiến Quốc gia và Đại học Shizuoka ở Nhật Bản đã công bố nghiên cứu ứng dụng Aptamer để điều chỉnh sự biệt hóa tế bào cơ tim trong tế bào gốc phôi (ESCs) trên tạp chí The International Journal of Molecular Sciences. Trong nghiên cứu này, các nhà nghiên cứu đã phát hiện ra rằng một Aptamer kháng nucleolin (oligodeoxynucleotide iSN04) tạo ra sự biệt hóa cơ tim trong tế bào gốc phôi (ESCs). Nghiên cứu này chỉ ra tác động của Aptamer iSN04 lên tế bào gốc phổi chuột (ESCs) và tế bào gốc đa năng cảm ứng (iPSC). Kết quả nghiên cứu cho thấy sự ức chế nucleolin của Aptamer iSN04 tạo điều kiện cho sự biệt hóa tế bào trung bì tim ở giai đoạn muộn thành tế bào cơ tim, nhưng cũng đồng thời cản trở tế bào trung bì tim ở giai đoạn sớm đi vào chu trình biệt hóa. Đây là báo cáo dầu tiên về việc sử dụng Aptamer DNA can thiệp vào quá trình tạo tế bào cơ tim, bên cạnh đó Aptamer iSN04 cũng không gây ra biến đổi đến các con đường khác trong cơ thể.
Aptamer trong trị liệu nhắm mục tiêu
Kích thước nhỏ và đặc tính linh động của oligonucleotide mang lại cho Aptamer những ưu thế nổi bật hơn so với kháng thể protein cả về khả năng ứng dụng rộng rãi trong lâm sàng cũng như quy trình tổng hợp dễ dàng hơn trong quy mô công nghiệp.
Các điểm nổi bật của aptamer bao gồm:
(i) Aptamer với kích thước phân tử nhỏ (8-25 kDa) có thể xâm nhập vào các mô nhanh và hiệu quả hơn so với kháng thể (kích thước ~150 kDa). Từ đó, Aptamer có thể xuyên qua hàng rào mô và tiếp cận đến mục tiêu trong cơ thể hiệu quả hơn so với các protein có kích thước lớn.
(ii) Aptamer gần như không gây ra phản ứng miễn dịch in vivo. Về nguyên tắc, vì Aptamer là oligonucleotide nên hệ thống miễn dịch thường không nhận ra chúng. Thực tế, các nghiên cứu lâm sàng cũng cho thấy Aptamer không kích thích phản ứng miễn dịch trong in vivo so với các kháng thể protein có tính sinh miễn dịch cao, đặc biệt là sau khi được tiêm nhắc lại.
(iii) Aptamer bền với nhiệt. Dựa trên các đặc tính sẵn có của oligonucleotide, ngay cả sau khi bị biến tính ở 95 °C Aptamer cũng có thể hồi phục lại cấu hình 3D chính xác của chúng khi được làm lạnh về nhiệt độ phòng. Trong khi đó, các kháng thể dựa trên protein sẽ bị mất hoạt tính vĩnh viễn khi ở nhiệt độ cao.
(iv) Quan trọng hơn, với quy trình tổng hợp và công nghệ hóa học được thiết lập tốt có thể giúp tổng hợp và biến đổi Aptamer theo yêu cầu trên quy mô lớn , nhanh chóng và chứa nhiều nhóm chức năng khác nhau.
(v) Aptamer ít bị biến đổi cấu trúc trong quá trình tổng hợp hóa học.
(vi) Chi phí tổng hợp và sản xuất thấp hơn.
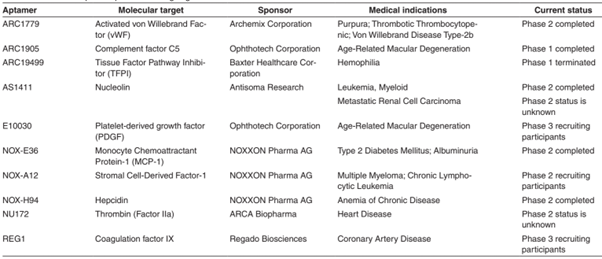
Ví dụ, một Aptamer RNA (Macugen) được biến đổi và đặc biệt nhắm vào yếu tố tăng trưởng nội mô mạch máu đã được Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) phê duyệt để điều trị chứng thoái hóa điểm vàng liên quan đến tuổi tác và cũng đang được xem xét để ứng dụng và các tình trạng bệnh khác. Trong điều trị ung thư, Aptamer AS1411 nhắm tới nucleolin, một loại protein biểu hiện quá mức ở nhiều loại khối u. Nó hiện đang được đánh giá là một sự lựa chọn điều trị tiềm năng đối với các khối u rắn và bệnh bạch cầu dòng tủy cấp tính. Dưới đây là một danh sách cập nhật các Aptamer có khả năng trị liệu đang được thử nghiệm lâm sàng (Bảng 1). Dựa vào bảng, chúng ta có thể thấy những nghiên cứu lâm sàng này làm nổi bật nhiều ứng dụng của Aptamer có thể mang lại trong lĩnh vực y sinh, bao gồm cả phần trị liệu.
Bảng 1: Danh sách các Aptamer sử dụng trong trị liệu đang được thử nghiệm lâm sàng.
Kết luận
Aptamer đang được tập trung nghiên cứu và phát triển như những hợp chất có tính khả thi trong chẩn đoán và lâm sàng. Chúng đại diện cho những loại phân tử độc đáo có chức năng tương tự nhưng nhỏ hơn kháng thể và có dược động học độc đáo, có thể sử dụng cho nhiều mục đích khác nhau mà gần như không gây nên các phản ứng miễn dịch. Sự phát triển nhanh chóng của chúng trong hai thập kỉ qua là rất đáng chú ý và chúng tôi dự đoán rằng chúng sẽ sớm trở thành công cụ hữu ích cho các bác sĩ lâm sàng trong tương lai gần. Dựa vào những ưu điểm nổi bật của Aptamer, hiện nay phòng Công nghệ Tích hợp IT-BT đang nghiên cứu chọn lọc Aptamer có khả năng liên kết mạnh mẽ với các loại virus/ vi khuẩn có hại và đã phát hành Quy trình chọn lọc Aptamer đặc hiệu với Virus viêm gan B và Tả lợn Châu Phi. Các Aptamer này hứa hẹn sẽ được ứng dụng để trở thành các công cụ tiềm năng để chẩn đoán bệnh do virus/vi khuẩn gây ra nhanh và có độ chính xác cao.
Tài liệu tham khảo
Lennarz, D. S., Christine Alich, M. T., Kelly, D. T., Blind, D. M., Heinz Beck, P. D., & Günter Mayer, P. D. (2015). Selective Aptamer‐Based Control of Intraneuronal Signaling. Angewandte Chemie (International Ed. in English), 54(18), 5369-5373. https://doi.org/10.1002/anie.201409597
Ishioka, M., Nihashi, Y., Sunagawa, Y., Umezawa, K., Shimosato, T., Kagami, H., Morimoto, T., & Takaya, T. (2023). Myogenetic Oligodeoxynucleotide Induces Myocardial Differentiation of Murine Pluripotent Stem Cells. International Journal of Molecular Sciences, 24(18). https://doi.org/10.3390/ijms241814380Srivastava
S, Abraham PR, Mukhopadhyay S. Aptamers: An Emerging Tool for Diagnosis and Therapeutics in Tuberculosis. Front Cell Infect Microbiol. 2021 Jul 1;11:656421. doi: 10.3389/fcimb.2021.656421. PMID: 34277465; PMCID: PMC8280756.
Yamamoto M, Miyoshi M, Morioka K, Mitani T, Takaya T. Anti-nucleolin aptamer, iSN04, inhibits the inflammatory responses in C2C12 myoblasts by modulating the β-catenin/NF-κB signaling pathway. Biochem Biophys Res Commun. 2023 Jul 5;664:1-8. doi: 10.1016/j.bbrc.2023.04.098. Epub 2023 Apr 26. PMID: 37127012.
Zou, X., Wu, J., Gu, J., Shen, L., & Mao, L. (2019). Application of Aptamers in Virus Detection and Antiviral Therapy. Frontiers in Microbiology, 10, 454278. https://doi.org/10.3389/fmicb.2019.01462
Bai, H., Wang, R., Hargis, B., Lu, H., and Li, Y. (2012). A SPR aptasensor for detection of avian influenza virus H5N1. Sensors 12, 12506–12518. doi: 10.3390/s120912506
Nguyen, V. T., Seo, H. B., Kim, B. C., Kim, S. K., Song, C. S., and Gu, M. B. (2016). Highly sensitive sandwich-type SPR based detection of whole H5Nx viruses using a pair of aptamers. Biosens. Bioelectron. 86, 293–300. doi: 10.1016/j.bios.2016.06.064
Nie, J., Deng, Y., Deng, Q. P., Zhang, D. W., Zhou, Y. L., and Zhang, X. X. (2013). A self-assemble aptamer fragment/target complex based high-throughput colorimetric aptasensor using enzyme linked aptamer assay. Talanta 106, 309–314. doi: 10.1016/j.talanta.2012.11.018
ThS. Phan Thị Ngọc Hoa
Phòng Công nghệ Tích hợp IT-BT





